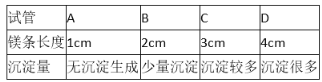
题目内容
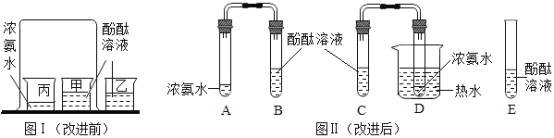
【题目】(1)某市售天然矿泉水标签的部分内容如下图所示,请仔细阅读完成下列问题
①用填空符号钙离子________,硫酸根离子_______。
②该矿泉水属于_______(填“混合物”或“纯净物”)。
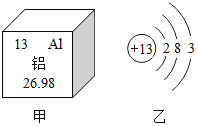
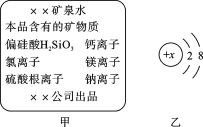
③硅属于______(填“金属”或“非金属”)元素,某离子带2个单位的正电荷,其结构示意图如图乙所示,则x值为______,该离子属于_______(填“阳离子”或“阴离子”)。
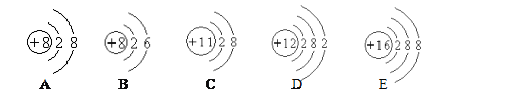
(2)下表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
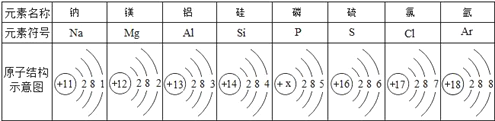
①___决定原子的种类; ②表中具有相对稳定结构的元素的元素符号是___; ③上述元素在周期表中处于同一周期的原因是______; ④原子的化学性质与______有关; ⑤同周期元素的原子最外层电子的变化是____________。
【答案】Ca2+SO42-混合物非金属12阳离子质子数Ar核外电子层数相同最外层电子数依次增加一个
【解析】
(1)①钙离子是一个钙原子失去两个电子形成的,带两个单位的正电荷,符号为Ca2+,故填Ca2+;
硫酸根离子的符号为SO42-,故填SO42-。
②矿泉水是水和几种物质组成的混合物,故填混合物。
③由硅的名称带“石”字旁可知硅元素属于非金属元素,故填非金属;
离子带2个单位的正电荷可知,形成该离子的原子中由12个电子,质子数为12,所以x的值为12,故填12;
该离子的质子数大于核外电子数,所以该离子为阳离子,故填阳离子。
(2)①不同的原子质子数不同,所以决定原子种类的是原子的质子数,故填质子数;
②具多电子层的原子最外层电子数为8成为稳定结构,上述具稳定结构的是氩,元素符号为Ar,故填Ar。
③上述元素的原子核外电子层数相同,都有三个电子层,属于同一周期,故填核外电子层数相同。
④原子最外层电子数不同,在化学反应中得到或失去电子的数目不同,因而所属元素化学性质不同,故填最外层电子数。
⑤同一周期元素的原子,其最外层电子数依次增加一个,故填依次增加一个。