题目内容
(2009?香坊区一模)某同学想探究贝壳中碳酸钙的质量分数,取贝壳50g高温加热,完全反应后称量固体剩余物质量为32.4g,则贝壳中碳酸钙的质量分数( )
【答案】分析:根据碳酸钙高温分解生成氧化钙和二氧化碳,反应前后固体的质量差即为分解所放出二氧化碳的质量,由二氧化碳质量计算出50g贝壳中所含碳酸钙的质量,碳酸钙质量与贝壳质量比可计算贝壳中碳酸钙的质量分数.
解答:解:根据质量守恒定律,50g贝壳高温加热完全反应后放出二氧化碳的质量=50g-32.4g=17.6g
设贝壳中碳酸钙的质量为x
CaCO3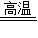 CaO+CO2↑
CaO+CO2↑
100 44
x 17.6g
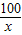 =
=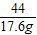 x=40g
x=40g
贝壳中碳酸钙的质量分数=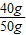 ×100%=80%
×100%=80%
故选C.
点评:根据化学方程式进行计算时,所使用的质量必须为纯净物的质量,由于题中剩余的32.4g固体物质可能含有杂质,因此,不能直接使用该质量进行计算.
解答:解:根据质量守恒定律,50g贝壳高温加热完全反应后放出二氧化碳的质量=50g-32.4g=17.6g
设贝壳中碳酸钙的质量为x
CaCO3
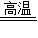 CaO+CO2↑
CaO+CO2↑100 44
x 17.6g
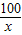 =
=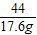 x=40g
x=40g贝壳中碳酸钙的质量分数=
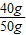 ×100%=80%
×100%=80%故选C.
点评:根据化学方程式进行计算时,所使用的质量必须为纯净物的质量,由于题中剩余的32.4g固体物质可能含有杂质,因此,不能直接使用该质量进行计算.

练习册系列答案
相关题目
(2009?香坊区一模)小明的父亲买回一些钾肥,其包装袋上的部分内容如图所示,为确定该化肥的纯度是否符合标准,小明同学取10g化肥样品加入50g某盐酸盐溶液恰好完全反应后,过滤、洗涤、烘干得沉淀的质量为11.65g
(1)写出所加溶液中的溶质______;
(2)发生反应的化学方程式______;
(3)10g该化肥中K2S04的质量为______;
(4)通过计算该化肥的纯度是否符合包装袋上的说明______;
(5)所用盐酸盐溶液中溶质的质量分数______;
(6)恰好完全反应时所得溶液中溶质的质量分数______.
| 名称:硫酸钾 化学式:K2SO4 纯度:95% ×××化肥厂 |
(2)发生反应的化学方程式______;
(3)10g该化肥中K2S04的质量为______;
(4)通过计算该化肥的纯度是否符合包装袋上的说明______;
(5)所用盐酸盐溶液中溶质的质量分数______;
(6)恰好完全反应时所得溶液中溶质的质量分数______.
(2009?香坊区一模)复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个实验.
探究1:研究常见物质性质--氢氧化钠与硫酸是否刚好完全中和.
(1)探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量.
(2)验证:
写出 (2)中涉及的化学方程式______.
探究2:研究常见物质制取______制取氢氧化钠溶液.
甲同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
乙同学却说:“这种无色溶液中不一定含有氢氧化钠.”他提出了如下实验:
丙同学认为乙的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是______.
丙同学设计了另一个实验:
我认为:显然丙同学的实验可靠性比甲、乙的实验好,原因是______.
探究1:研究常见物质性质--氢氧化钠与硫酸是否刚好完全中和.
(1)探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量.
(2)验证:
| 实验内容 | 实验现象 | 解释与结论 |
| 取少量反应后的溶液与试管中,加入锌粒 | ______ | 证明研究结论正确 |
探究2:研究常见物质制取______制取氢氧化钠溶液.
甲同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
乙同学却说:“这种无色溶液中不一定含有氢氧化钠.”他提出了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
丙同学设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ______ | ______ | 无色溶液中确实含有氢氧化钠 |