题目内容
我们知道,高温煅烧石灰石(主要成份是碳酸钙)可制得生石灰(即氧化钙)和二氧化碳。为了分析产品的纯度,小舜同学取石灰石样品22g,充分煅烧后称得剩余固体的质量为13.2g(提示:假定杂质不反应)。计算:
(1)生成二氧化碳的质量是多少克?这些二氧化碳在标准状况下的体积是多少升?(标准状况下CO2的密度1.977g/L)
(2)制得生石灰的质量是多少克?其产品的纯度是多少?
(1)生成二氧化碳的质量是多少克?这些二氧化碳在标准状况下的体积是多少升?(标准状况下CO2的密度1.977g/L)
(2)制得生石灰的质量是多少克?其产品的纯度是多少?
解:(1)根据质量守恒定律可知,
生成二氧化碳的质量为:22g-13.2g=8.8g。
二氧化碳的体积为:8.8g÷1.977g/L=4.45L
(2)设生成生石灰的质量为x
CaCO3 CaO + CO2↑
CaO + CO2↑
56 44
x 8.8g
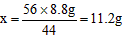
则所得产品的纯度为:(11.2g/13.2g)×100%=84.85%
生成二氧化碳的质量为:22g-13.2g=8.8g。
二氧化碳的体积为:8.8g÷1.977g/L=4.45L
(2)设生成生石灰的质量为x
CaCO3
 CaO + CO2↑
CaO + CO2↑56 44
x 8.8g
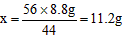
则所得产品的纯度为:(11.2g/13.2g)×100%=84.85%

练习册系列答案
相关题目