题目内容
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如下图所示.由此推断白色固体中
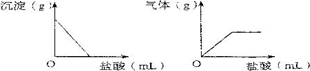
[ ]
A.可能存在NaOH
B.可能存在Na2SO4
C.肯定不存在BaCl2
D.肯定只存在Na2CO3
答案:A
解析:
解析:
|
依题意,分步推断如下:①根据“取样溶于水,有白色沉淀产生”的现象,推断能形成白色沉淀的反应物可能是Na2SO4、Na2CO3、BaCl2;②根据“向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系图示”,表明沉淀全部溶于盐酸,沉淀不可能是BaSO4,应是BaCO3,说明形成沉淀的原白色固体中肯定不存在Na2SO4、肯定同时存在Na2CO3、BaCl2;而NaOH与Na2SO4、Na2CO3、BaCl2均不发生反应,可能在溶于水、过滤后存在于滤液中,即该白色固体中可能存在NaOH. |

练习册系列答案
相关题目
 (2008?上海)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
(2008?上海)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( ) (2013?武清区一模)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
(2013?武清区一模)有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )