题目内容
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
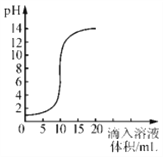
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH_______7 (填“大于”或“小于”或“等于”)。该反应的化学方程式为___________。
(2)根据曲线判断,该反应是将___________(填“氢氧化钠溶液”或“盐酸”)滴入___________中。
(3)当滴入溶液的体积为5 mL时,此时该溶液中的溶质是___________(填化学式)。
(4)将8Og 10%的氢氧化钠溶液与一定质量的10%的稀盐酸相混合,滴入几滴石蕊溶液,溶液呈紫色,则稀盐酸的质量为__________73g(填“大于”或“等于”或“小于”)。
【答案】 等于 NaOH+HCl=NaCl+H20 氢氧化钠溶液 盐酸 HCl和NaCl 等于
【解析】(1)氢氧化钠和盐酸恰好完全反应时,溶液呈中性,pH=7;反应的化学方程式为:HCl+NaOH=NaCl+H2O;(2)根据曲线判断,溶液的pH逐渐增大,是向盐酸中滴加氢氧化钠溶液;(3)盐酸和氢氧化钠的反应原理是:HCl+NaOH=NaCl+H2O,滴入氢氧化钠溶液的体积为5mL时,溶液仍为酸性,所以是氢氧化钠只和部分盐酸反应,所得溶液中的溶质化学式为:HCl、NaCl;(4)将8Og10%的氢氧化钠溶液与一定质量的10%的稀盐酸相混合,滴入几滴石蕊溶液,溶液呈紫色,说明两者恰好完全反应,设需要稀盐酸的质量为x,则:
HCl+NaOH=NaCl+H2O
35.5 40
![]()
![]()
![]()
x=73g。

练习册系列答案
相关题目