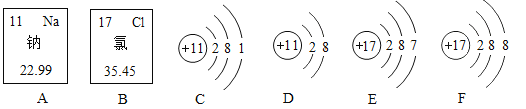
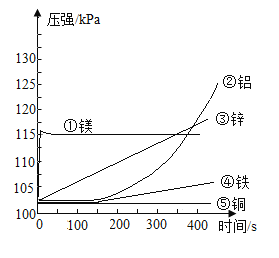
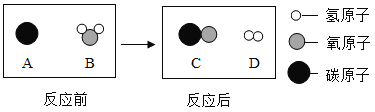
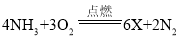题目内容
【题目】(1)某实验小组从河水中取出的水样呈淡黄色,有异味,水样浑浊,有固体颗粒,于是进行净化处理:首先加入明矾搅拌,静置一段时间后,进行__________,除去固体颗粒,再加入________,利用其__________性除去水样中的颜色和异味。
(2)生活中既能降低水的硬度,又能杀菌消毒的方法是__________。
(3)二氧化氯(ClO2)是一种强力杀菌剂,实验室常用下列方法制取二氧化氯:![]() ,则x的化学式为_______________。
,则x的化学式为_______________。
(4)图1是电解水的实验装置,通电后试管B中的气体是__________,图2中参加反应的水和生成的氢气、氧气的微粒个数比为__________,该实验说明水是由_______元素组成。
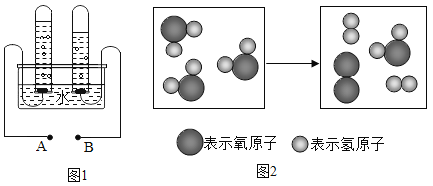
【答案】过滤 活性炭 吸附 煮沸 H2O H2 2:2:1 氢、氧(H、O)
【解析】
(1)某实验小组从河水中取出的水样呈淡黄色,有异味,水样浑浊,有固体颗粒,于是进行净化处理:首先加入明矾搅拌,静置一段时间后,进行过滤,除去固体颗粒,再加入活性炭(具有疏松多孔状结构),利用其吸附性除去水样中的颜色和异味。
(2)生活中既能降低水的硬度,又能杀菌消毒的方法是:加热、煮沸;煮沸过程中钙离子和镁离子会形成沉淀,水的硬度降低,高温可以杀菌;
(3)二氧化氯(ClO2)是一种强力杀菌剂,实验室常用下列方法制取二氧化氯:![]() ,该反应前后各元素的原子个数不变,生成物比反应物少4个氢原子和2个氧原子,X的化学计量数为2,则x的化学式为H2O;
,该反应前后各元素的原子个数不变,生成物比反应物少4个氢原子和2个氧原子,X的化学计量数为2,则x的化学式为H2O;
(4)图1是电解水的实验装置, 2H2O![]() 2H2↑+O2↑通电后正极产生氧气,体积小,负极产生氢气,体积大;试管B中的气体体积大,是氢气,图2中参加反应的水和生成的氢气、氧气的微粒个数比=化学方程式中化学计量数之比=2:2:1,该实验说明水是由氢元素和氧元素组成。
2H2↑+O2↑通电后正极产生氧气,体积小,负极产生氢气,体积大;试管B中的气体体积大,是氢气,图2中参加反应的水和生成的氢气、氧气的微粒个数比=化学方程式中化学计量数之比=2:2:1,该实验说明水是由氢元素和氧元素组成。

 阅读快车系列答案
阅读快车系列答案【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。

(提出猜想)
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,因为镁条可能会与空气中的其他成分发生反应
(进行实验)
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物还夹杂着极少量淡黄色的固体。 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
(解释与结论)
(1)镁条与氧气反应的化学方程式为_____。
(2)步骤Ⅰ说明装置的气密性_____。
(3)步骤Ⅱ中,关闭止水夹的目的是_____。
(4)根据实验现象中的_____(写一个)可以推测猜想2成立。
(继续探究)经查阅资料得知氮化镁(Mg3N2)为淡黄色的固体。
(设计实验)设计实验证明镁与氮气发生了反应:_____。
(实验结论)镁条与氮气反应的化学方程式为:_____。
(反思与评价)通过上述探究活动,你对燃烧有什么新的认识?_____。