题目内容
19、将18.4g NaOH和NaHCO3的混合物在密闭的容器中加热到约250°C,经充分反应排出气体,冷却,称量所得固体质量为16.6g.则原混合物中NaOH的质量分数是多少?
分析:首先分析反应原理:因为实在密闭容器中进行反应,所以存在过量问题,因为二者可以发生反应NaOH+NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答.
所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答.
解答:解:由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题.
设18.4g混合物正好完全反应,减少的质量为x.
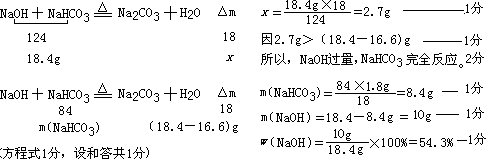
答:原混合物中NaOH的质量分数为54.3%.
设18.4g混合物正好完全反应,减少的质量为x.
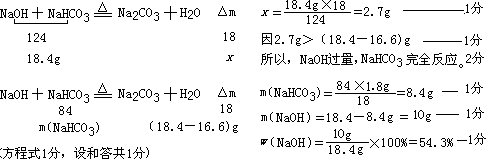
答:原混合物中NaOH的质量分数为54.3%.
点评:本题难度很大,一是判断反应过量问题,二是怎样判断过量.
在判断过量中为什么2.7g>(18.4g-16.6g),就判断为氢氧化钠过量呢?
因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.
在判断过量中为什么2.7g>(18.4g-16.6g),就判断为氢氧化钠过量呢?
因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.

练习册系列答案
相关题目