题目内容
实验室用浓盐酸和MnO2制取并探究Cl2(氯气)化学性质,装置如下: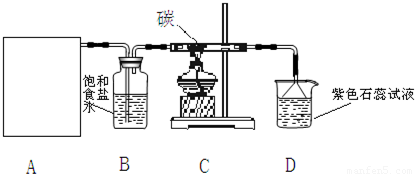
(1)A是Cl2发生装置,请完成反应的方程式:MnO2+4HCl(浓)
 ______+Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有______.
______+Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有______.(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式______ 4HCl+CO2↑(
【答案】分析:根据实验室制氯气的原理及质量守恒定律推断化学式;根据实验现象推断影响反应的因素.稀盐酸与浓盐酸的不同点:稀盐酸中含有氢离子和氯离子.
解答:解:(1)根据质量守恒定律,反应前后原子种类、个数不变,可推知所缺物质化学式为MnCl2; 仪器名称为:酒精灯、导管
(2)C装置中的反应物为氯气、水和碳,生成物为氯化氢和二氧化碳,根据化学方程式书写原则写出化学方程式为:2Cl2+2H2O+C 4HCl+CO2↑
4HCl+CO2↑
(3)稀盐酸中含有的离子是氯离子和氢离子,故猜想2为H+的浓度对反应的影响,要设计证明氯离子的浓度对反应是否有影响,可增大氯离子的浓度,看是否产生黄绿色气体,若设计证明氢离子可增大氢离子浓度,因此实验方案如下:
①稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热;若有黄绿色气体生成,则与氯离子浓度有关,
若没有黄绿色气体生成,则与氯离子浓度无关.;
②将将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热;若有黄绿色气体生成,则与氢离子浓度有关,
若没有黄绿色气体生成,则与氢离子浓度无关.;
故答案为:(1)MnCl2; 酒精灯、导管
(2)2Cl2+2H2O+C 4HCl+CO2↑
4HCl+CO2↑
(3)①假设2:H+的浓度对反应的影响 ②
点评:本题考查质量守恒定律及实验方案的设计,会根据物质的不同点找出影响反应速率的因素,会设计实验方案证明.
解答:解:(1)根据质量守恒定律,反应前后原子种类、个数不变,可推知所缺物质化学式为MnCl2; 仪器名称为:酒精灯、导管
(2)C装置中的反应物为氯气、水和碳,生成物为氯化氢和二氧化碳,根据化学方程式书写原则写出化学方程式为:2Cl2+2H2O+C
 4HCl+CO2↑
4HCl+CO2↑(3)稀盐酸中含有的离子是氯离子和氢离子,故猜想2为H+的浓度对反应的影响,要设计证明氯离子的浓度对反应是否有影响,可增大氯离子的浓度,看是否产生黄绿色气体,若设计证明氢离子可增大氢离子浓度,因此实验方案如下:
①稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热;若有黄绿色气体生成,则与氯离子浓度有关,
若没有黄绿色气体生成,则与氯离子浓度无关.;
②将将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热;若有黄绿色气体生成,则与氢离子浓度有关,
若没有黄绿色气体生成,则与氢离子浓度无关.;
故答案为:(1)MnCl2; 酒精灯、导管
(2)2Cl2+2H2O+C
 4HCl+CO2↑
4HCl+CO2↑(3)①假设2:H+的浓度对反应的影响 ②
| 将稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热 | 若有黄绿色气体生成,则与氯离子浓度有关, 若没有黄绿色气体生成,则与氯离子浓度无关. | |
| 将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热 | 若有黄绿色气体生成,则与氢离子浓度有关, 若没有黄绿色气体生成,则与氢离子浓度无关. |
点评:本题考查质量守恒定律及实验方案的设计,会根据物质的不同点找出影响反应速率的因素,会设计实验方案证明.

练习册系列答案
相关题目

