题目内容
【题目】某溶液含有H+、Na+、Mg2+、Fe3+、Cl-、OH-、NO、CO中的几种离子。经检测pH=13,取溶液少许于试管中,加入足量稀盐酸,无明显现象,继续滴加硝酸银溶液产生白色沉淀,则溶液中一定含有的离子是________;可能含有的离子是________________。
【答案】
![]()
【解析】pH=13,说明溶液中一定含有OH-,则Mg2+、Fe3+、H+不能存在,因为Mg2+、Fe3+会与氢氧根离子产生沉淀,氢离子和氢氧根离子反应产生水;则阳离子只剩余了钠离子,故一定含有钠离子;
当取溶液少许于试管中,加入足量稀盐酸,无明显现象,则说明CO32-不存在,因为碳酸根离子与盐酸反应产生二氧化碳气体;
继续滴加硝酸银溶液产生白色沉淀,则说明由氯离子,但是氯离子是原溶液的还是盐酸中的就不能确定了;
故一定含有的是:Na+和OH-;可能含有的离子是Cl-和NO3-;
故答案为:Na+和OH-;Cl-和NO3-.

 导学全程练创优训练系列答案
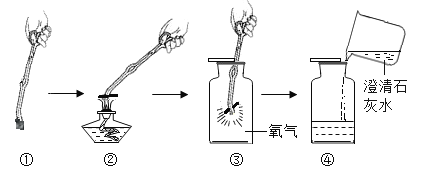
导学全程练创优训练系列答案【题目】某课外小组的同学利用老师提供的下列仪器、药品进行实验探究
(1)甲同学设计了两种制取氧气的方案
A 把二氧化锰加入盛有过氧化氢溶液的试管中;
B 把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中。
能得到平稳氧气流的是_____,(填A或B)
(2)老师提供的红砖粉末有什么作用?乙同学联想二氧化锰作过氧化氢的催化剂,于是想到红砖粉末是否也可以作过氧化氢的催化剂?请你一起参与探究,并回答有关问题
(猜想与假设)红砖粉末能作过氧化氢分解的催化剂。
(实验验证)乙同学设计了如下三个实验:
实验:取一定量过氧化氢溶液于试管中,观察到有极少量气泡产生,将带火星的木条伸入试管中,木条没有复燃。说明过氧化氢在常温下分解缓慢。
实验二:在实验一的试管中加入1克红砖粉末,有大量气泡产生,伸入带火星的木条,木条复燃。说明_____。
实验三:待反应结束后,将试管中的不溶物滤出,并洗涤、于燥、称量,固体的质量仍为1克,说明_____
(实验结论)乙同学认为红砖粉末可以作过氧化氢分解的催化剂。
(反思评价)丙同学认为要证明乙同学的结论正确,还需要再补充一个探究实验这一探究实验的目的是_____。
(拓展)下表是丁同学探究影响过氧化氢分解速率的因素时所记录的数据,通过对数据的分析,你得到的结论是_____。
催化剂及其质量 反应结束所需要的时间/min 过氧化氢溶液的浓度 | 30% | 15% | 5% |
W克二氧化锰 | 0.3 | 0.9 | 2.1 |
W克红砖粉末 | 8.0 | 10.0 | 17.0 |
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.
实验中采用图1实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200ml氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
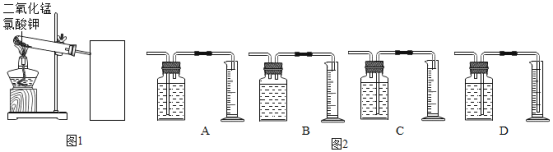
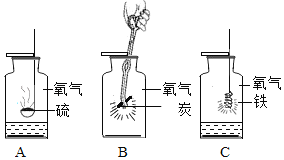
(1)为完成本实验,方框内应选择图2气体收集装置中的是_____(选填序号)该收集利用了氧气的_____性质.收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好,请写出前者的两个优点①_____②
(4)催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因是_____.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_____.