题目内容
【题目】据2012年4月15日中央电视台《每周质量报告》报道,一些不法厂商使用重金属铬超标的工业明胶代替食用明胶来生产药用胶囊. 
(1)如图所示,根据铬元素在元素周期的部分信息,铬元素原子的核电荷数是 , 相对原子质量是 .
(2)铬是一种银白色金属,在自然界中主要以铬铁矿(FeCr2O4)形式存在.已知FeCr2O4中铁元素为+2价,则铬元素的化合价为 .
(3)铬可与浓硫酸反应,形成硫酸铬[Cr2(SO4)3]、二氧化硫和另一种常见的氧化物,反应的化学方程式是 .
【答案】
(1)24;52.00
(2)+3
(3)2Cr+6H2SO4(浓)=Cr2(SO4)3+3SO2↑+6H2O
【解析】解:(1)由题目中的图可知原子序数为24;再根据“原子序数=核内质子数=核外电子数=核电荷数”,可知该元素的原子的核电荷数24,;由图可知其相对原子质量为52.00;(2)铁元素显+2价,氧元素显﹣2价,根据化合价原则,在化合物中元素的化合价的代数和为零,设铬元素的化合价为a,则+2+2a+(﹣2)×4=0,解得a=+3;(3)根据质量守恒定律,化学反应前后元素的种类不变,反应物中有氢元素,生成物中缺少氢元素,故常见的氧化物为水,反应的化学方程式 为:2Cr+6H2SO4(浓)=Cr2(SO4)3+3SO2↑+6H2O;
所以答案是:(1)24;52.00;(2)+3;(3)2Cr+6H2SO4(浓)=Cr2(SO4)3+3SO2↑+6H2O;
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号.

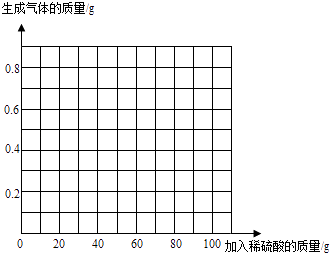
【题目】为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入硫酸,充分反应后用天平称量,记录实验数据如下:
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量 | 50.0 | 50.0 | 50.0 | 50.0 |
加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物完全反应完了.
(2)50.0g样品与足量稀硫酸反应最多能生成气体g
(3)计算样品中锌的质量分数(写出具体计算过程).
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系.