��Ŀ����
����Ŀ�����÷���˼ά���ǻ�ѧ��ѧ����ɫ��
���û�ѧ���ű�ʾ��
�� пԪ��____________�� �� 2����������___________��
�� ����������________�� �� ������������������_____��
��ѡ�������ʵ���������գ�����ĸ��ţ���
A������ B����̿ C�����ʯ D�������
E��һ����̼ F������ G�������� H����ºϽ�
��������ɫ��Դ_____�� �ڿ���������˿_____�� ����Ȼ��Ӳ��������_______��
��Ǧ�����е���_____�� ����ʹѪ�쵰���ж�����_____�� ���Ϸ���__________��
�Ǹ������з�Ӧ��ʵд����Ӧ�Ļ�ѧ����ʽ��
�ٳ����£���������������Ӧ���γ����ܵ�������Ĥ_____��
�ڵ��ˮ��_____��
��һ����̼���������ڸ����·�Ӧ_____��
���⻯�ƣ�CaH2����ˮ��Ӧ�����������ƺ�һ�����嵥�ʣ�_____��
���𰸡� Zn 2Fe2+ P2O5 H2O A H C F E D 4Al��3O2 ![]() 2Al2O3 2H2O
2Al2O3 2H2O![]() 2H2����O2�� Fe2O3 + 3CO
2H2����O2�� Fe2O3 + 3CO![]() 2Fe + 3CO2 CaH2��2H2O��Ca(OH)2��2H2��
2Fe + 3CO2 CaH2��2H2O��Ca(OH)2��2H2��
�����������⿼���˳�����ѧ�������д�Լ��������ʵ����ʺ���;��
��1����пԪ�ص�Ԫ�ط���Ϊ��Zn��
�����ӵı�ʾ�������ڱ�ʾ�����ӵ�Ԫ�ط������Ͻǣ���������������������������������ǰ�����������ں�1�����ʱ��1Ҫʡ������ʾ��������ӣ�������Ԫ�ط���ǰ������Ӧ�����֣���2���������ӿɱ�ʾΪ��2Fe2+��
����������������Ԫ�صĻ��ϼ�Ϊ+5�ۣ���Ԫ�صĻ��ϼ�Ϊ-2�ۣ��仯ѧʽΪ��P2O5��
����������������������ˮ���仯ѧʽΪ��H2O��
��2��������ȼ�ղ�����ˮ������Ⱦ��������������ɫ��Դ������ºϽ��۵�ͣ�����������˿�� ����Ȼ��Ӳ�������ǽ��ʯ����Ǧ�����е�������� ����ʹѪ�쵰���ж�����һ����̼�� ��������к��е�Ԫ�غͼ�Ԫ�أ��dz��õĸ��Ϸ��ϣ��ʴ�Ϊ�� A��H��C�� F�� E�� D��
��3���ٳ����£���������������Ӧ��������������Ӧ�Ļ�ѧ����ʽΪ��Al+3O2=2Al2O3��
��ˮ�ڵ��������·�Ӧ������������������Ӧ�Ļ�ѧ����ʽΪ��2H2O![]() 2H2����O2����
2H2����O2����
��һ����̼���������ڸ����·�Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3 + 3CO![]() 2Fe + 3CO2��
2Fe + 3CO2��
���⻯�ƣ�CaH2����ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��CaH2+2H2O=Ca��OH��2+2H2����

 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�����Ŀ��ijС��ͬѧ��Ʋ�����ʵ�飬̽��Ӱ���������ֽ����ʵ����ء���ʵ��װ����ͼ��ʾ���г���������ȥ��
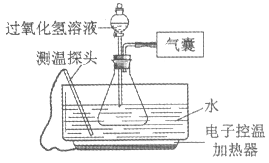
����������衿Ӱ���������ֽ����ʵ����ؿ������¶ȡ���Һ��Ũ�ȡ��������ࡣ
��ʵ���¼��ͬѧ�ǽ���6��ʵ�飬ʵ���¼���£�
ʵ����� | �� | �� | �� | �� | �� | �� |
����������Һ��Ũ�ȣ����� | 30 | 30 | 15 | 30 | 30 | 30 |
����������Һ�������mL�� | 6 | x | 6 | 6 | 6 | 6 |
ˮ����ˮ���¶� | 20 | 90 | 70 | 70 | 20 | 20 |
��ƿ�е����� | ���� | ���� | ���� | ���� | 0.5g NaCl | 0.5g NaCl3 |
60 min�ڲ��������������mL�� | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
����������ۡ�
��1��ʵ�����Ӧ�������������Һ�����x��_______mL��
��2��ʵ��١���ͨ���ⶨ��ͬʱ���ڲ���������������ȽϹ�������ķֽ����ʣ�������ͨ���ⶨ_______���ȽϹ�������ķֽ����ʡ�
��3���ó�������������Һ��Ũ��Խ��ֽ�����Խ���������ݵ�ʵ����_______������ţ���
��4��ͨ��ʵ��١��ڡ��ܿɵó��Ľ�����_______��
��5��ʵ��Ļ�ѧ����ʽΪ_______��
����˼�����ۡ�
��6��ͬѧ����Ϊʵ������������Ӧѡ��ʵ�����ѡʵ��ڵ�������_______ �������㣩��
����Ŀ������ѡ�������ʵ����ơ���������ѧʽ�������ȫһ�µ���
ѡ�� | ���� | ���� | ��ѧʽ | ��� |
A | ������ | ��ʯ�� | CaO | ������ |
B | �Ȼ��� | �� | NaCl | ���� |
C | �������� | ˫��ˮ | H2O2 | ˮ |
D | �������� | ��ʯ�� | Ca(OH)2 | �� |
A.AB.BC.CD.D
