题目内容
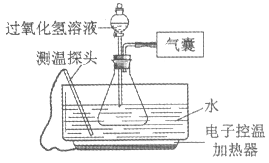
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)
【猜想与假设】影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
【实验记录】同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | —— | —— | —— | —— | 0.5g NaCl | 0.5g NaCl3 |
60 min内产生氧气的体积(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
【解释与结论】
(1)实验②中应加入过氧化氢溶液的体积x是_______mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定_______来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_______(填序号)。
(4)通过实验①、②、④可得出的结论是_______。
(5)实验⑥的化学方程式为_______。
【反思与评价】
(6)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是_______ (答两点)。
【答案】 6 产生相同体积的氧气所需的时间 ③④ 在相同条件下,温度越高,过氧化氢分解速率越大 2H2O2![]() 2H2O+O2↑ 产生氧气少;需要加热;水蒸气含量高
2H2O+O2↑ 产生氧气少;需要加热;水蒸气含量高
【解析】(1)由于实验研究影响过氧化氢分解速率的因素温度、溶液的浓度、催化剂种类。所以要保证过氧化氢溶液的体积相同,所以x=6;(2)比较过氧化氢的分解速率可通过相同时间内产生氧气的体积或产生相同体积的氧气所需的时间,进行比较;(3)过氧化氢溶液的浓度越大分解速率越大,所以实验的变量为:过氧化氢溶液的浓度,所以可通过③④进行对比;(4)①、②、④的变量为水槽中水的温度,并且发现温度越高,过氧化氢分解速率越大;(5) 实验⑥是过氧化氢在氯化钠的催化作用下反应生成水和氧气,化学方程式为: ![]()
![]()
![]() ;(6)相同时间内实验②产生氧气少,速率太慢并且由于水温过高,水蒸气含量高。
;(6)相同时间内实验②产生氧气少,速率太慢并且由于水温过高,水蒸气含量高。