题目内容
(2006?栖霞区二模)小军为了制取纯净的二氧化碳气体,并验证碳、一氧化碳等物质的化学性质,应用图中所示的仪器设计了一套实验装置进行实验.回答下列问题:
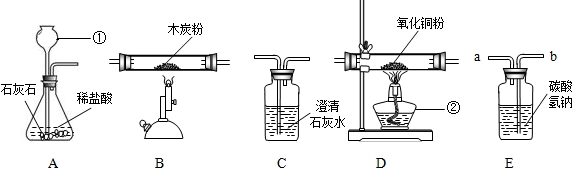
(1)写出图中所标仪器的名称:①
(2)装置图的连接顺序应是:由:A→
(3)在连接装置 E 时,气体必须由
(4)装置E的作用是
(5)装置C的作用是
(6)实验室现需制取6.6g二氧化碳,至少需要含杂质30%的石灰石(杂质不与酸反应)多少克?(C-12;O-16;Ca-40)

(1)写出图中所标仪器的名称:①
长颈漏斗
长颈漏斗
;②酒精灯
酒精灯
.(2)装置图的连接顺序应是:由:A→
E、
E、
→B、
B、
→D、
D、
→C
C
.(填装置序号,不得重复使用)(3)在连接装置 E 时,气体必须由
b
b
进入(选用a、b填写).(4)装置E的作用是
除去CO2中所含的HCl气体
除去CO2中所含的HCl气体
.(5)装置C的作用是
检验生成的气体中有CO2生成
检验生成的气体中有CO2生成
,发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H20
Ca(OH)2+CO2═CaCO3↓+H20
(6)实验室现需制取6.6g二氧化碳,至少需要含杂质30%的石灰石(杂质不与酸反应)多少克?(C-12;O-16;Ca-40)
分析:(1)熟悉常见仪器的名称和用途;
(2)根据实验的目的、过程分析连接装置;
(3)在除杂质时,应将气体通入液体中;
(4)根据制取的二氧化碳中含有的杂质分析;
(5)根据二氧化碳与氢氧化钙的反应分析;
(6)根据盐酸与碳酸钙的反应进行计算.
(2)根据实验的目的、过程分析连接装置;
(3)在除杂质时,应将气体通入液体中;
(4)根据制取的二氧化碳中含有的杂质分析;
(5)根据二氧化碳与氢氧化钙的反应分析;
(6)根据盐酸与碳酸钙的反应进行计算.
解答:解:(1)由图示可知标号仪器①是长颈漏斗②是酒精灯;
(2)实验室用大理石和稀盐酸反应制取二氧化碳中常含有氯化氢气体,可用碳酸氢钠溶液除去,再将二氧化碳与碳在高温条件下反应制取一氧化碳,将一氧化碳与氧化铜反应.所以连接的顺序是:A→E→B→D→C;
(3)在连接装置E 时,应将气体通入液体中,必须由b进入;
(4)由于制取二氧化碳中常含有氯化氢气体,所以装置E的作用是:除去CO2中所含的HCl气体;
(5)由于二氧化碳与氢氧化钙的反应,所以,通过装置C来检验生成的气体中有CO2生成,反应的方程式是:Ca(OH)2+CO2═CaCO3↓+H20;
(6)设至少需要含杂质30%的石灰石的质量为x,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
(1-30%)x 6.6g
=
解得:X=21.4g
故答为:(1)长颈漏斗,酒精灯; (2)E、B、D、C;(3)b; (4)除去CO2中所含的HCl气体;(5)检验生成的气体中有CO2生成,Ca(OH)2+CO2═CaCO3↓+H20;(6)21.4g.
(2)实验室用大理石和稀盐酸反应制取二氧化碳中常含有氯化氢气体,可用碳酸氢钠溶液除去,再将二氧化碳与碳在高温条件下反应制取一氧化碳,将一氧化碳与氧化铜反应.所以连接的顺序是:A→E→B→D→C;
(3)在连接装置E 时,应将气体通入液体中,必须由b进入;
(4)由于制取二氧化碳中常含有氯化氢气体,所以装置E的作用是:除去CO2中所含的HCl气体;
(5)由于二氧化碳与氢氧化钙的反应,所以,通过装置C来检验生成的气体中有CO2生成,反应的方程式是:Ca(OH)2+CO2═CaCO3↓+H20;
(6)设至少需要含杂质30%的石灰石的质量为x,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
(1-30%)x 6.6g
| 100 |
| 44 |
| (1-30%)x |
| 6.6g |
故答为:(1)长颈漏斗,酒精灯; (2)E、B、D、C;(3)b; (4)除去CO2中所含的HCl气体;(5)检验生成的气体中有CO2生成,Ca(OH)2+CO2═CaCO3↓+H20;(6)21.4g.
点评:本题难度不大,综合性较强,考查二氧化碳的制取装置及含杂质物质化学反应的计算,掌握纯净物的质量=不纯物的质量×纯净物的质量分数是正确解答本题的关键所在.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 (2006?栖霞区二模)A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况.B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.向烧杯中加入某种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质可能是( )
(2006?栖霞区二模)A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况.B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.向烧杯中加入某种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质可能是( ) (2006?栖霞区二模)做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
(2006?栖霞区二模)做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )