题目内容
(2006?栖霞区二模)二氧化硫是大气污染物之一,表一为我国环境空气质量标准中对每次空气质量测定中的S02最高浓度限值.
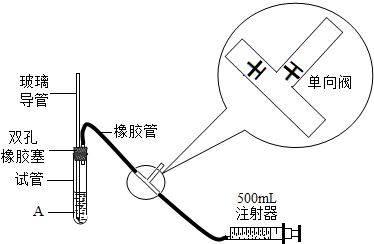
国家环保总局规定从2005年1月1日起将各类实验室纳入环保监管范围.为粗略地测定周围环境中的SO2含量,某课外活动小组设计了如下图的实验装置.
(1)检查装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后向外轻轻拉动注射器的活塞时,将会看到
(2)已知二氧化硫与碘水的反应为:SO2+I2+2H2O═H2SO4+2HI.向试管中加入1.0mL溶质质量分数为1.27×10-4的碘水( 此时溶液的密度与水的密度近似 ),用适量的蒸馏水稀释后再加入2~3滴无色淀粉溶液(遇到碘单质变蓝色),配制成溶液A.测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由
(3)课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,分别测量化学实验室和教室的空气中的S02含量.当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL).请将表二填写完整(计算时保留二位有效数字).(I-127 S-32 O-16)
表二 不同组别的测量值
(4)通过测定并计算,你判断出所测化学实验室的空气中S02的含量属于

| S02最高浓度限值(单位mg?m-3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
(1)检查装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后向外轻轻拉动注射器的活塞时,将会看到
浸没在水中的玻璃导管口有气泡冒出
浸没在水中的玻璃导管口有气泡冒出
(填写实验现象),则证明该装置的气密性良好.(2)已知二氧化硫与碘水的反应为:SO2+I2+2H2O═H2SO4+2HI.向试管中加入1.0mL溶质质量分数为1.27×10-4的碘水( 此时溶液的密度与水的密度近似 ),用适量的蒸馏水稀释后再加入2~3滴无色淀粉溶液(遇到碘单质变蓝色),配制成溶液A.测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由
蓝
蓝
色变为无
无
色时反应恰好完全进行.(3)课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,分别测量化学实验室和教室的空气中的S02含量.当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL).请将表二填写完整(计算时保留二位有效数字).(I-127 S-32 O-16)
表二 不同组别的测量值
| 组 别 | 第一小组(实验室) | 第二小组(教室) |
| 抽气次数 | 110 | 150 |
| 空气中S02的含量(单位:mg?m-3) |
三级
三级
标准(填表一中所列举的等级).分析:弄清装置气密性的检验必须要保证装置能形成一个密闭的体系和引起密闭体系内的压强的变化,由于当注射器推活塞时,①关闭,②打开;当注射器拉活塞时,①打开,②关闭,因此检查该装置的气密性时,为使形成一个密闭的空间,应拉注射器的活塞,使装置内的压强减小,从而在浸没在水中的玻璃导管口会看到有气泡冒出.由于SO2+I2+2H2O=H2SO4+2HI,当单质碘恰好完全反应时,淀粉遇碘变成的蓝色就会消失,从而根据参加反应的碘的质量即可求出二氧化硫的质量,从而确定此地空气中二氧化硫的含量.
解答:解:(1)若要检验该装置的气密性,首先理解单向阀的作用:单向阀原理说明:当注射器推活塞时,①关闭,②打开;当注射器拉活塞时,①打开,②关闭.因此应该外拉注射器的活塞,导致试管内压强减小,若看到浸没在水中的玻璃管口处有气泡冒出,说明气密性良好.故答案为:浸没在水中的玻璃导管口有气泡冒出;
(2)从提供的化学方程式不难看出,当反应物恰好完全反应时,溶液中不再有单质碘,溶液的蓝色就会消失.故答案为:蓝;无;
(3)由于所取得碘水是一样的,因此两组实验中参与反应的二氧化硫的质量一样多,为了使二氧化硫气体完全被吸收,因此抽拉气体时要缓缓地进行.根据化学方程式计算,设参与反应的二氧化硫的质量为X.
SO2+I2+2H2O=H2SO4+2HI
64 254
X 1g×0.0127%
=
X=0.000032g=0.032mg
第一组:
=0.58mg/m3
第二组:
=0.43mg/m3
故答案为:第一组:=0.58mg/m3;第二组:0.43mg/m3.
(4)由于第二组抽气速率过快,造成空气中SO2与碘水未充分反应,产生较大误差,所以第一组更实际符合.所测化学实验室的空气中S02的含量属于三级.故答案为:三级.
(2)从提供的化学方程式不难看出,当反应物恰好完全反应时,溶液中不再有单质碘,溶液的蓝色就会消失.故答案为:蓝;无;
(3)由于所取得碘水是一样的,因此两组实验中参与反应的二氧化硫的质量一样多,为了使二氧化硫气体完全被吸收,因此抽拉气体时要缓缓地进行.根据化学方程式计算,设参与反应的二氧化硫的质量为X.
SO2+I2+2H2O=H2SO4+2HI
64 254
X 1g×0.0127%
| 64 |
| X |
| 254 |
| 1g×0.0127% |
X=0.000032g=0.032mg
第一组:
| 0.032mg |
| 500×110×10-6m3 |
第二组:
| 0.032mg |
| 500×150×10-6m3 |
故答案为:第一组:=0.58mg/m3;第二组:0.43mg/m3.
(4)由于第二组抽气速率过快,造成空气中SO2与碘水未充分反应,产生较大误差,所以第一组更实际符合.所测化学实验室的空气中S02的含量属于三级.故答案为:三级.
点评:主要对空气中二氧化硫的含量进行了探究,该题有一定的深度,难度较大,主要培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 (2006?栖霞区二模)A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况.B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.向烧杯中加入某种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质可能是( )
(2006?栖霞区二模)A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况.B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体.向烧杯中加入某种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质可能是( ) (2006?栖霞区二模)做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
(2006?栖霞区二模)做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示.下列判断正确的是( )