��Ŀ����
����Ŀ���������ҹ�ijЩ����������Ⱦ��Ϊ���أ���Ҫ�ɴ���ȼ�պ������ߵ�ú����ɡ�
��������⣩
���ͨ��ʵ��֤��ú�к���̼Ԫ�غ���Ԫ�ء�
���������ϣ�
I������������ʹ���������Һ��ɫ�����Ϻ�ɫ��Ϊ��ɫ�����÷�Ӧ�Ļ�ѧ����ʽΪ��
5SO2+2KMnO4+2H2O��K2SO4+2MnSO4+2H2SO4��
II����������Ͷ�����̼һ�����ܺͳ���ʯ��ˮ������Ӧ����������ˮ��������ƣ�CaSO3����
��1����д����������ʹ����ʯ��ˮ����ǵĻ�ѧ����ʽ��_____��
�����������ϣ�������ѧ������ѧ��ȤС�����ʵ�鷽��������̽����
��ʵ��̽����
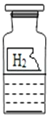
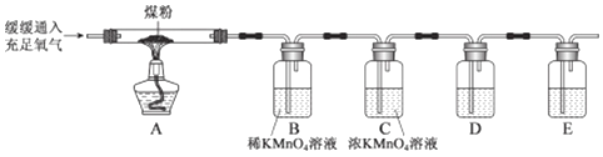
��ͬѧ��������ͼ��ʾʵ�飨����װ����ͼ����ȥ����
��̽������ۣ�
��2��C װ�õ�������_____��
��3��D װ����ʢ�ŵ���_____�����Լ����ƣ���
��4��E װ�����ڼ��������̼���� E װ���ڷ����Ļ�ѧ��Ӧ����ʽΪ_____��
��5����ʵ������Ҫ֤��ú�к���̼Ԫ�غ���Ԫ�أ�Ӧ������ʵ�������ǣ�_____��
��6��Ϊ�˷�����ɫ��ѧ�������̼�ŷţ�����װ��ĩ���ټ�һƿ_____���ѧʽ����Һ��
���𰸡�Ca��OH��2+SO2�TCaSO3��+H2O ���ն������� ���������Һ Ca��OH��2+CO2�TCaCO3��+H2O B�����Ϻ�ɫ��Ϊ��ɫ��D����Һ����ɫ��E�г���ʯ��ˮ����ǡ� NaOH
��������
��1����������ʹ����ʯ��ˮ����ǣ�����Ϊ����������������Ʒ�Ӧ����������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ca��OH��2+SO2�TCaSO3��+H2O��
���Ca��OH��2+SO2�TCaSO3��+H2O��
��2��C װ�õ����������ն�������ֹ�Լ��������̼����Ӱ�졣
������ն�������
��3��D װ����ʢ�ŵ��Ǹ��������Һ������������������Ƿ�Cװ����ȫ���ա�
������������Һ��
��4��E װ�����ڼ��������̼���� E װ�����dz���ʯ��ˮ���������ƺͶ�����̼��Ӧ����̼��Ƴ�����ˮ�������Ļ�ѧ��Ӧ����ʽΪ��Ca��OH��2+CO2�TCaCO3��+H2O��
���Ca��OH��2+CO2�TCaCO3��+H2O��
��5����ʵ������Ҫ֤��ú�к���̼Ԫ�غ���Ԫ�أ�Ӧ������ʵ�������ǣ�B�����Ϻ�ɫ��Ϊ��ɫ��D����Һ����ɫ��E�г���ʯ��ˮ����ǡ�
���B�����Ϻ�ɫ��Ϊ��ɫ��D����Һ����ɫ��E�г���ʯ��ˮ����ǡ�
��6��Ϊ�˷�����ɫ��ѧ�������̼�ŷţ�����װ��ĩ���ټ�һƿNaOH��Һ���������ն�����̼��
���NaOH��