题目内容
(1)宁德毗邻东海,盐资源丰富。
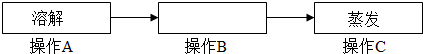
①粗盐提纯主要分为下列三个操作步骤:

请填写操作B的名称 。
②在粗盐提纯的实验中,蒸发滤液时,若等完全蒸干后再停止加热,会导致的后果是 。
A.食盐固体飞溅 B.食盐质量增多 C.食盐溶解
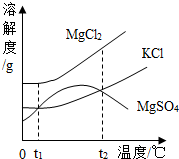
③晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线示意图:

设t2℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则a、b、c的大小关系为 。
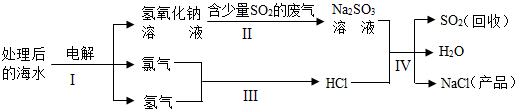
(2)近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下:

①在该“流程图”中,从海水最终得到“NaCl(产品)”的过程属于 (填“物理变化”或“化学变化”)。
②图中反应I、II、III属于化合反应的是 (填序号)。
③反应IV的化学方程式为 。
(1)①过滤;②A;③a>b=c;(2)①化学变化;②III;③Na2SO3+2HCl。2NaCl+H2O+SO2↑
【解析】
试题分析:(1)①粗盐提纯时需要除去不溶性的固体杂质,所以溶解后要进行的操作B是过滤;
②在蒸发食盐溶液时,若等完全蒸干后再停止加热,会导致的后果是食盐固体飞溅;
③由MgCl2、KCl和MgSO4三种物质的溶解度曲线可知,t2℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则a、b、c的大小关系为a>b=c;
(2)①从海水最终得到“NaCl(产品)”是反应生成的氯化钠,该变化属于化学变化;
②氯气和氢气反应生成氯化氢的反应属于化合反应;
③反应IV的化学方程式为:Na2SO3+2HCl=2NaCl+H2O+SO2↑。
考点:考查氯化钠与粗盐提纯;混合物的分离方法