题目内容
(2013?宁德)闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下:
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率
(2)该小组测得的产率偏低,可能的原因是
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
[进行实验]请你与他们共同完成,并回答所给的问题:
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是
(2)写出工艺流程图步骤Ⅳ的化学方程式

某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率
88.9%
88.9%
(保留一位小数).(2)该小组测得的产率偏低,可能的原因是
AC
AC
.A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是
B
B
(填字母序号).
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
| 阴离子 阳离子 |
OH- |
| ||
| Ca2+ | 微 | 不 | ||
| Mg2+ | 不 | 微 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2 已 已 (填“已”或“未”)除尽 |
| 步骤二:往步骤一所得溶液中加入适量的 碳酸钠 碳酸钠 溶液 |
产生白色沉淀 | 说明溶液中含有CaCl2 |
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是
氯化钠的溶解度受温度变化影响很小
氯化钠的溶解度受温度变化影响很小
.(2)写出工艺流程图步骤Ⅳ的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
分析:【实验一】
(1)根据精盐、粗盐的质量可以计算精盐的产率;
(2)操作不当可能影响计算结果;
(3)过滤时应该用玻璃棒引流.
【实验二】
[进行实验]
碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;
[拓展思维]
(1)有些物质的溶解度受温度变化影响大,有些物质的溶解度受温度变化影响小;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式.
(1)根据精盐、粗盐的质量可以计算精盐的产率;
(2)操作不当可能影响计算结果;
(3)过滤时应该用玻璃棒引流.
【实验二】
[进行实验]
碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;
[拓展思维]
(1)有些物质的溶解度受温度变化影响大,有些物质的溶解度受温度变化影响小;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式.
解答:解:【实验一】(1)溶解的粗盐质量为:5.0g-1.4g=3.6g,
精盐的产率为:
×100%=88.9%.
故填:88.9%.
(2)溶解时未充分搅拌,氯化钠可能没有完全溶解;蒸发时盐粒溅出蒸发皿,导致精盐的质量减小;以上两种情况能使测得的产率偏低.
故填:AC.
(3)B中过滤时应该用玻璃棒引流,而B中没有.
故填:B.
【实验二】[进行实验]
步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液时,无明显现象,说明氯化镁已经除尽.
故填:已.
步骤二:往步骤一所得溶液中加入适量的碳酸钠溶液,产生白色沉淀,说明溶液中含有氯化钙.
故填:碳酸钠.
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是氯化钠的溶解度受温度变化影响很小.
故填:氯化钠的溶解度受温度变化影响很小.
(2)饱和食盐水在通电条件下反应能生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
故填:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
精盐的产率为:
| 3.2g |
| 3.6g |
故填:88.9%.
(2)溶解时未充分搅拌,氯化钠可能没有完全溶解;蒸发时盐粒溅出蒸发皿,导致精盐的质量减小;以上两种情况能使测得的产率偏低.
故填:AC.
(3)B中过滤时应该用玻璃棒引流,而B中没有.
故填:B.
【实验二】[进行实验]
步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液时,无明显现象,说明氯化镁已经除尽.
故填:已.
步骤二:往步骤一所得溶液中加入适量的碳酸钠溶液,产生白色沉淀,说明溶液中含有氯化钙.
故填:碳酸钠.
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是氯化钠的溶解度受温度变化影响很小.
故填:氯化钠的溶解度受温度变化影响很小.
(2)饱和食盐水在通电条件下反应能生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O
| ||
故填:2NaCl+2H2O
| ||
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
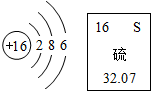 (2013?宁德质检)从图中得到的正确信息是
(2013?宁德质检)从图中得到的正确信息是 (2013?宁德质检)(1)用化学用语表示:
(2013?宁德质检)(1)用化学用语表示: