��Ŀ����
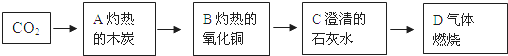
����Ŀ����1����ͼ�dz��нγ�����װ�ã���ش�

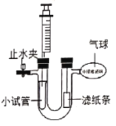
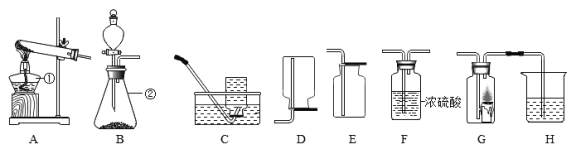
ʵ����Ҫ��ȡ����������̼��ѡ�õ���ѷ���װ��_____������ĸ��д����ͬ������ѧ����ʽ_____��ʵ�����ڳ������ÿ�״��ʯ��ˮ��Ӧ��ȡ��Ȳ��C2H2�����壬���ڸ÷�Ӧʮ�־��ң�ʵ������ϸ���Ʒ�Ӧ���ʣ����ͼ1װ����ѡ����װ��ȡһƿ�������Ȳ�����װ�ã���ȷ������˳��Ϊ_____��
��2��ˮ�ǻ�ѧ�Լ����õ��ܼ���ˮ������Ԫ�غ���Ԫ����ɡ���һ�����ǿ�ѧ�����ڴ���ʵ��Ļ����ϵó��ġ�
����ѧ������������ⷨ��֤����ˮ����ɣ�����������������������ķ���_____��
��������������һʵ��֤����ˮ����ɡ�����ˮ����ͨ��һ���պ������ǹ�ܣ�����õ���������ͬʱǹ�ܱ����к�ɫ���壨���������Ҫ�ɷ֣����ɡ��÷�Ӧ�Ļ�ѧ����ʽΪ_____��
������������ԭ����ͭ��ʵ��Ҳ����֤��ˮ����ɣ�ͼ2����װ��A�еIJ����ܺ����������ڷ�Ӧǰ���������Ϊm1��װ��B�����������ڷ�Ӧǰ���������Ϊm2���ݴ˿ɼ����ˮ��O��HԪ�ص�������Ϊ_____���ú�m1��m2�Ĵ���ʽ��ʾ����
���𰸡�B CaCO3+2HCl��CaCl2+H2O+CO2�� ecdf ��ȼ�ŵ�ľ������ 4H2O������+3Fe![]() Fe3O4+4H2 m1����m2��m1��
Fe3O4+4H2 m1����m2��m1��
��������
��1��ʵ������ȡ������̼�ķ�Ӧ���ǹ����Һ�壬��Ӧ�����dz��£�����ѡ�õ���ѷ���װ��B��̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��CaCO3+2HCl��CaCl2+H2O+CO2����ʵ������ȡ��Ȳ�ķ�Ӧ���ǹ����Һ�壬ʵ������ϸ���Ʒ�Ӧ���ʣ�Ũ���������ˮ�ԣ�������ȷ������˳��Ϊecdf��
��2��������������ȼ�ԣ����Լ���������������ķ����ǣ���ȼ�ŵ�ľ�����飻
������ˮ�����ڸ��µ�������������������������������ѧ����ʽΪ��4H2O������+3Fe![]() Fe3O4+4H2��
Fe3O4+4H2��
��װ��A�еIJ����ܺ����������ڷ�Ӧǰ���������Ϊm1��������ͭ�м��ٵ���Ԫ�ص�������Ҳ����ˮ����Ԫ������Ϊm1��װ��B�����������ڷ�Ӧǰ���������Ϊm2��������������ͭ��Ӧ���ɵ�ˮ����������ˮ�������ǣ�m2������ˮ����Ԫ������Ϊ��m2��m1������O��HԪ�ص�������Ϊm1����m2��m1����
�ʴ�Ϊ����1��B��CaCO3+2HCl��CaCl2+H2O+CO2����ecdf��
��2������ȼ�ŵ�ľ�����飻
��4H2O������+3Fe![]() Fe3O4+4H2��
Fe3O4+4H2��
��m1����m2��m1����