题目内容
【题目】根据下列装置进行实验,请你参与并回答:

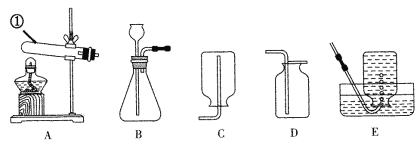
(1)仪器①的名称是_____。
(2)写出实验室用A制氧气的化学方程式_____;收集氧气的装置可选_____(填字母序号),理由是_____。
(3)实验室制取二氧化碳,可选用的发生装置是_____(填字母序号);若用装置C收集二氧化碳气体,气体由_____(填“a”或“b”)端进入;检验二氧化碳是否收满的方法是_____。
【答案】试管 ![]() D或E 氧气的密度比空气大或不易溶于水 B a 把燃着的木条放在b导管口处,如果木条熄灭,则集满
D或E 氧气的密度比空气大或不易溶于水 B a 把燃着的木条放在b导管口处,如果木条熄灭,则集满
【解析】
(1)仪器①的名称是试管;
(2)装置A有酒精灯且试管口有棉花,适合加热高锰酸钾制取氧气,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,化学方程式为:![]() ;氧气的密度比空气大,氧气不易溶于水可用向上排空气法或排水法收集,收集装置可选有D或E;
;氧气的密度比空气大,氧气不易溶于水可用向上排空气法或排水法收集,收集装置可选有D或E;
(3)实验室常用石灰石(或大理石)和稀盐酸反应制取二氧化碳,该反应的反应物是固体和液体,不需加热,可选用B作发生装置;二氧化碳的密度比空气大,可用向上排空气法收集,若用装置C收集二氧化碳气体,气体由a端进入;二氧化碳不能燃烧也不能支持燃烧,能使燃着的木条熄灭。检验二氧化碳是否收满的方法是把燃着的木条放在b导管口处,如果木条熄灭,则集满。

 阅读快车系列答案
阅读快车系列答案【题目】在小英家的仓库里,堆放着一袋袋化肥一一碳酸氢铵(NH4HCO3)。过了一个夏天,小英发现这种化肥所特有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。
为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
(提出问题)碳酸氢铵粉末消失的原因是什么?
(猜想)①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(查阅资料)①碳酸氢铵属于氨肥,不具有升华的性质,说明上述猜想_____(填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液是碱性,但干燥的氨气不能使干燥的红色石蕊试剂变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应,其化学方程式为_____。
(实验操作,现象与结论)
实验操作 | 实验现象 | 实验结论 |
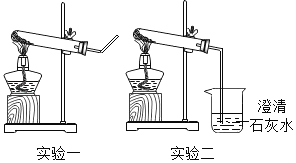
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有_____,没有___ |
②按如图二所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物中有____ |
(应用)①利用氨气的化学性质,请写出实验室检验氨气的方法(写出实验操作、现象、结论):_____;
②如果你家里有碳酸氢铵化肥,你应该如何保存?_____。
【题目】某兴趣小组同学探究了影响过氧化氢溶液分解率度的某种因素,实验数据记录如下表
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | 二氧化锰的质量 | 相同时间内产生O2的体积 | |
① | 50.0g | 1% | 0.1g | 9mL |
② | Xg | 2% | 0.1g | 16mL |
③ | 50.0g | 4% | 0.1g | 31mL |
(1)为了精确对比,②中X的值应为_____,③中反应的符号表达式为:_____。
(2)兴趣小组同学测量氧气体积应为图中的_____(填序号)装置。
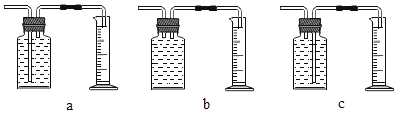
实验结论:在相同条件下,过氧化氢溶液浓度越_____,分解速率越快