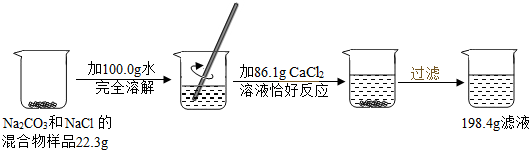
题目内容
请根据如图所示的实验过程和提供的数据,计算样品中钠元素的质量.
已知:Na2CO3+CaCl2=CaCO3↓+2NaCl
已知:Na2CO3+CaCl2=CaCO3↓+2NaCl

根据质量守恒定律结合题给的数据可以知道生成碳酸钙的质量为:22.3g+100.0g+86.1g-198.4g=10.0g,所以可以据此进行求算;
设混合物中碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x10.0g
=
解得:x=10.6g
所以混合物中氯化钠的质量为22.3g-10.6g=11.7g;
所以在混合物中钠元素的质量为:10.6g×(
×100%)+11.7g×(
×100%)=4.6g+4.6g=9.2g;
答:样品中钠元素的质量为9.2g.
故答案为:9.2g.
设混合物中碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x10.0g
| 106 |
| x |
| 100 |
| 10.0g |
解得:x=10.6g
所以混合物中氯化钠的质量为22.3g-10.6g=11.7g;
所以在混合物中钠元素的质量为:10.6g×(
| 46 |
| 106 |
| 23 |
| 58.5 |
答:样品中钠元素的质量为9.2g.
故答案为:9.2g.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 ;
; 

