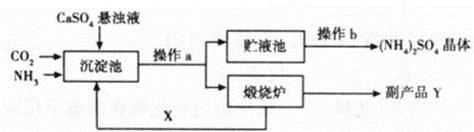
题目内容
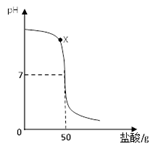
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题: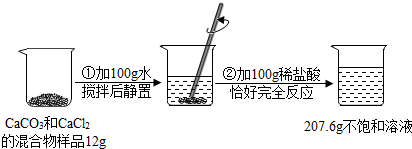
(1)实验所用稀盐酸的溶质的质量分数为 7.3%.
(2)计算原混合物样品中CaCl2的质量(写出计算过程).
7.3%;2g
解析试题分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成的二氧化碳的质量;再利用化学方程式,根据二氧化碳的质量可求出盐酸中溶质的质量和参加反应的碳酸钙的质量;
解:(1)生成二氧化碳的质量为:100g+12g+100g—207.6g=4.4g
设参加反应的盐酸质量为x,碳酸钙的质量为y,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
y x 4.4g
73/x=44/4.4g
x=7.3g
7.3g/100g×100%=7.3%
(2)100/y=44/4.4g
y=10g
12g—10g=2g
答:所用盐酸的质量分数为7.3%,原混合物中的CaCl2的质量为2g
考点:利用化学方程式的计算

 黄冈创优卷系列答案
黄冈创优卷系列答案实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后(固体质量不再变化时)固体变为9.04g,再将固体加水充分溶解、过滤、干燥得到1.59g黑色固体。求10g剩余固体混合物中氯元素的质量分数为
| A.7.1% | B.35.5% | C.28.4% | D.42.6% |
(12分)水是生命之源,是自然界中重要的物质。
Ⅰ.温泉的利用是人们开发地热的一种形式,南京汤山温泉具有悠久的文化。
(1)清澈的温泉水是 (填“纯净物”或“混合物”)。
(2)净化温泉水的过程中,会使用到活性炭,主要是利用其 作用。
(3)鉴别温泉水是硬水还是软水需加入的试剂是 。
Ⅱ.海水是巨大的资源宝库。海水晾晒可得到粗盐,已知某粗盐样品中除泥沙外还含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下: 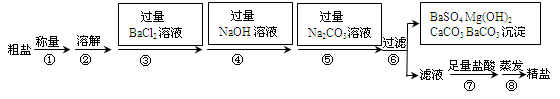
(1)用托盘天平称量10.2g粗盐样品时,若指针偏向左边,则表示(填字母序号) 。
| A.右盘重,砝码轻 | B.右盘轻,样品少 |
| C.左盘重,样品多 | D.左盘轻,砝码重 |
(3)第⑤步操作的目的是 。
(4)在第⑦步操作中,向滤液中滴加足量盐酸的目的是 。
Ⅲ.水也是一种重要的原料。某工厂用电解水的方法来制取氧气,若制取100kg氧气,理论上消耗水的质量是多少?(写出计算过程)
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质。其原理是把蛋白质中的氮元素完全转化成氨气(化学式为NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
现取该牛奶样品30 mL,用“盖尔达法”分解其中的蛋白质,产生的氨气用9.5 g溶质质量分数为4.9%的稀硫酸恰好完全吸收。计算并回答下列问题:
(1)产生氨气的质量是多少克?(计算结果精确到0.01 g,下同)
(2)30 mL牛奶中含氮元素的质量是多少克?
(3)下图是该牛奶包装标签的部分内容。已知牛奶中的蛋白质含氮元素的质量分数为16%,请你通过计算确定,该牛奶样品中蛋白质的含量是否达到了包装标签所标示的蛋白质的质量标准。
| 配料:鲜牛奶 保质期:8个月 净含量:250 mL/盒 营养成分:(每100 mL) 钙≥0.11 g 脂肪≥3.30 g 蛋白质≥2.90 g |