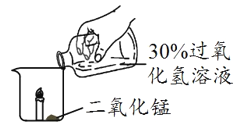
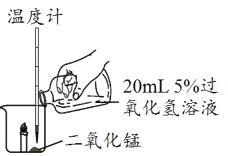
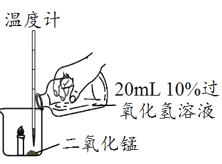
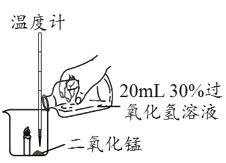
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ‘ΡΕΝœ¬ΟφΩΤΤ’ΕΧΈΡΓΘ
2019Ρξ «Ο≈ΫίΝ–ΖρΖΔΟςΒΡ‘ΣΥΊ÷ήΤΎ±μΒ°…ζ150÷ήΡξΘ§ΝΣΚœΙζ¥σΜα–ϊ≤Φ2019ΡξΈΣΓΑΙζΦ Μ·―ß‘ΣΥΊ÷ήΤΎ±μΡξΓ±
1869ΡξΘ§ΕμΙζΜ·―ßΦ“Ο≈ΫίΝ–Ζρ±ύ÷Τ≥ωΒΎ“Μ’≈‘ΣΥΊ÷ήΤΎ±μΓΘ’β’≈±μΈΣΜ·―ß―ßΩΤΒΡΫ®ΝΔ”κΖΔ’ΙΉω≥ωΝΥΒλΜυ–‘Ι±œΉΓΘ“ρ¥ΥΘ§Υϊ±Μ≥ΤΈΣ‘ΣΥΊ÷ήΤΎ±μ÷°ΗΗΓΘ
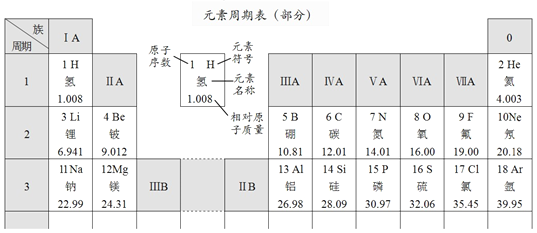
‘ΣΥΊ÷ήΤΎ±μ÷–ΟΩ“ΜΚα––≥…ΈΣ“ΜΗω÷ήΤΎΘ§Ι≤7Ηω÷ήΤΎΓΘΟΩ“ΜΉίΝ–≥ΤΈΣ“ΜΗωΉε(8ΓΔ9ΓΔ10»ΐΝ–Ι≤Ά§Ήι≥…“ΜΗωΉε)Θ§Ι≤”–16ΗωΉεΘ§Αϋά®7Ηω÷ςΉε(AΉε)ΓΔ7ΗωΗ±Ήε(BΉε)ΓΔΒΎΔχΉεΚΆ0ΉεΓΘ
‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΡήΖ¥”≥ΗΟ‘ΣΥΊΒΡ‘≠Ή”ΫαΙΙΓΘ‘ΣΥΊ÷ήΤΎ±μΑ¥‘ΣΥΊ‘≠Ή”ΚΥΒγΚ… ΐΒί‘ωΒΡΥ≥–ρΗχ‘ΣΥΊ±ύΚ≈Θ§Ϋ–Ήω‘≠Ή”–ρ ΐΓΘ‘≠Ή”–ρ ΐ”κ‘ΣΥΊ‘≠Ή”ΚΥΒγΚ… ΐ‘Ύ ΐ÷Β…œœύΆ§‘ΣΥΊ÷ήΤΎ ΐΒ»”ΎΚΥΆβΒγΉ”≤ψ ΐΘ§Ά§“Μ÷ήΤΎΒΡ‘ΣΥΊΒγΉ”≤ψ ΐœύΆ§Θ§άΐ»γΘΚΒΎ1÷ήΤΎΒΡ«βΓΔ«β‘ΣΥΊΒΡ‘≠Ή”ΚΥΆβΕΦ”–1ΗωΒγΉ”≤ψ(»γ”“ΆΦ)ΓΘ÷ςΉε(AΉε)‘ΣΥΊΒΡΉε ΐΒ»”ΎΉνΆβ≤ψΒγΉ” ΐΘ§Ά§“Μ÷ςΉε‘ΣΥΊΉνΆβ≤ψΒγΉ” ΐœύΆ§Θ§“ρ¥ΥΆ§“ΜΉεΒΡ‘ΣΥΊ”–Ή≈œύΥΤΒΡΜ·―ß–‘÷ ΓΘ
ΗυΨί‘ΣΥΊ÷ήΤΎ±μΩ…“‘ΆΤ≤β‘ΣΥΊΒΡ‘≠Ή”ΫαΙΙΦΑΤδ–‘÷ ΒΡΒί±δΙφ¬…ΓΘΩΤ―ßΦ“άϊ”Ο‘ΣΥΊ÷ήΤΎ±μΘ§―Α’“÷Τ»Γ¥ΏΜ·ΦΝΓΔΜ·―ß≈©“©ΓΔ–¬–Ά≤ΡΝœΒΡ‘ΣΥΊΓΘΫώΚσΜΙ”–ΗϋΕύΒΡΈ¥÷Σ‘ΣΥΊΒ»¥ΐΈ“Ο«ΦΧ–χΧΫΥςΓΘ
“άΨίΈΡ’¬ΡΎ»ίΜΊ¥πœ¬Ν–Έ ΧβΓΘ
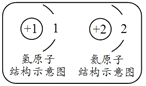
(1)œ¬Ν–ΩΤ―ßΦ“÷–Θ§±Μ≥ΤΈΣ‘ΣΥΊ÷ήΤΎ÷°ΗΗΒΡ «___(Χν–ρΚ≈Θ§œ¬Ά§)ΓΘ
A ά≠ΆΏΈΐ B ΒάΕϊΕΌ C Ο≈ΫίΝ–Ζρ
(2)‘ΣΥΊ÷ήΤΎ±μ÷–ΒΎ8‘ΣΥΊ «ΒΊΩ«÷–Κ§ΝΩΉνΕύΒΡ‘ΣΥΊΘ§ΗΟ‘ΣΥΊ «___(Χν‘ΣΥΊΟϊ≥Τ)ΓΘ
(3)ΟΨ‘ΣΥΊΈΜ”Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΡΒΎ___÷ήΤΎΓΔΒΎ___AΉεΓΘ
(4)Ρχ‘ΣΥΊ‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΡ–≈œΔ»γœ¬ΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «___ΓΘ

A ‘≠Ή”–ρ ΐ «28 B ΚΥΒγΚ… ΐ «28
C τ”ΎΖ«Ϋπ τ‘ΣΥΊ D œύΕ‘‘≠Ή”÷ ΝΩ «58.69
(5)œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «____
A ‘ΣΥΊ÷ήΤΎ±μ÷–Ι≤”–7Ηω÷ήΤΎΚΆ16ΗωΉε
B «βΓΔΚΛ‘≠Ή”ΒΡΒγΉ”≤ψ ΐœύΆ§
C ο°ΓΔΡΤΒΡΜ·―ß–‘÷ œύΥΤ
D ‘ΣΥΊ÷ήΤΎ±μΒΡΖΔΟς¥ΌΫχΝΥΜ·―ßΒΡΖΔ’Ι
ΓΨ¥πΑΗΓΩC ―θ‘ΣΥΊ »ΐ Δρ C ABCD
ΓΨΫβΈωΓΩ
Θ®1Θ©‘ΣΥΊ÷ήΤΎ±μ «”…Ο≈ΫίΝ–ΖρΖΔΟςΒΡΘ§Ι ―ΓCΓΘ
Θ®2Θ©ΒΊΩ«÷–Κ§ΝΩΉνΕύΒΡ‘ΣΥΊ «―θ‘ΣΥΊΓΘ
Θ®3Θ©ΟΨ‘ΣΥΊ «12Κ≈‘ΣΥΊΘ§‘≠Ή”Άβ”…»ΐΗωΒγΉ”≤ψΘ§ΉνΆβ≤ψΒγΉ” ΐ «2Θ§Ι «ΒΎ»ΐ÷ήΤΎΘ§ΒΎΕΰ÷ςΉεΓΘ
Θ®4Θ©AΓΔ”…ΆΦΩ…÷ΣΘ§Ρχ‘ΣΥΊΒΡ‘≠Ή”–ρ ΐ «28Θ§Ι A―Γœν’ΐ»ΖΘΜ
BΓΔ‘≠Ή”÷–‘≠Ή”–ρ ΐ=ΚΥΒγΚ… ΐΘ§Ι ΚΥΒγΚ… ΐ «28Θ§Ι B―Γœν’ΐ»ΖΘΜ
CΓΔ”…ΚΚΉ÷ΫαΙΙΩ…÷ΣΘ§Ρχ‘ΣΥΊ «Ϋπ τ‘ΣΥΊΘ§Ι C ―Γœν¥μΈσΘΜ
DΓΔ”…ΆΦΩ…÷ΣΘ§Ρχ‘ΣΥΊΒΡœύΕ‘‘≠Ή”÷ ΝΩ «58.69Θ§Ι D―Γœν’ΐ»ΖΓΘΙ ―ΓCΓΘ
Θ®5Θ©AΓΔ‘ΣΥΊ÷ήΤΎ±μ÷–Ι≤”–7Ηω÷ήΤΎΚΆ16ΗωΉεΘ§Ι A’ΐ»ΖΘΜ
BΓΔ«β‘≠Ή””–1ΗωΒγΉ”≤ψΓΔΚΛ‘≠Ή”“≤÷Μ”–“ΜΗωΒγΉ”≤ψΘ§Ι B’ΐ»ΖΘΜ
CΓΔο°ΓΔΡΤΒΡ‘≠Ή”ΒΡΉνΆβ≤ψΒγΉ” ΐΕΦ «1Θ§Ι Μ·―ß–‘÷ œύΥΤΘ§Ι C’ΐ»ΖΘΜ
DΓΔ‘ΣΥΊ÷ήΤΎ±μΒΡΖΔΟς¥ΌΫχΝΥΜ·―ßΒΡΖΔ’ΙΘ§Ι D’ΐ»ΖΓΘΙ ―ΓABCDΓΘ

 άΦΆΑΌΆ®ΤΎΡ©ΫπΨμœΒΝ–¥πΑΗ
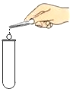
άΦΆΑΌΆ®ΤΎΡ©ΫπΨμœΒΝ–¥πΑΗΓΨΧβΡΩΓΩœ¬±μΧαΙ©ΝΥœθΥαΦΊΙΧΧε‘Ύ≤ΜΆ§Έ¬Ε» ±ΒΡ»ήΫβΕ»ΓΘ
Έ¬Ε»/Γφ | 0 | 20 | 40 | 60 | 80 |
»ήΫβΕ»/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
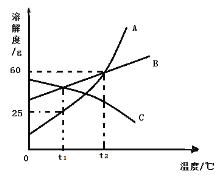
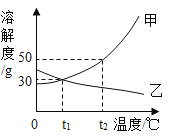
(1)20Γφ ±Θ§œρ50 gΥ°÷–Φ”»κ20 gœθΥαΦΊΘ§≥δΖ÷»ήΫβΚσΒΟΒΫ__________(―ΓΧν:±ΞΚΆΜρ≤Μ±ΞΚΆ)»ή“ΚΘ§»ή“ΚΒΡ»ή÷ ÷ ΝΩΖ÷ ΐΈΣ_________Θ®±ΘΝτ“ΜΈΜ–Γ ΐΘ©ΓΘ
(2)œ÷”–60Γφ ±ΒΡœθΥαΦΊ±ΞΚΆ»ή“Κ210 gΘ§»τΫΒΈ¬÷Ν20ΓφΘ§Έω≥ωœθΥαΦΊΨßΧεΒΡ÷ ΝΩ «____Θ§Ά®Ιΐ________≤ΌΉςΩ…ΫΪΈω≥ωΒΡœθΥαΦΊΨßΧεΚΆ»ή“ΚΖ÷άκΓΘ
(3)œ÷”–80Γφ ±»ή÷ ÷ ΝΩΖ÷ ΐΈΣ30%ΒΡœθΥαΦΊ»ή“ΚΘ§‘ρΫΒΈ¬ΒΫ________Θ®ΧνΉ÷ΡΗΘ©ΡήΒΟΒΫœθΥαΦΊ’κΉ¥ΨßΧεΓΘ
a. 0Γφ-20Γφ b. 20Γφ-40Γφ c. 40Γφ-60Γφ d. 60Γφ-80Γφ
(4)”Ο100g10%ΒΡœθΥαΦΊ»ή“Κ≈δ÷Τ5%ΒΡœθΥαΦΊ»ή“ΚΓΘ–η“ΣΦ”Υ°_______Όώ…ΐ(Υ°ΒΡΟήΕ»ΈΣ1.0gΓΛmL-1)
ΓΨΧβΡΩΓΩΡ≥Μ·―ß Β―ι–ΓΉιάϊ”Οά·÷ρΫχ––ΝΥœ¬Ν– Β―ιΓΘ
Β―ι1ΘΚ
–ρΚ≈ | 1-1 | 1-2 | 1-3 |
≤ΌΉς |
|
|
|
œ÷œσ | »Φ…’ΒΡά·÷ρ±Θ≥÷‘≠Ή¥ | »Φ…’ΒΡά·÷ρœ®Οπ | ΨγΝ“Ζ¥”ΠΘ§”–¥σΝΩΤχ≈ίΚΆΥ°Έμ…ζ≥…Θ§»Φ…’ΒΡά·÷ρœ®ΟπΝΥ |
(1) Β―ι1-2÷–Θ§»Φ…’ΒΡά·÷ρœ®ΟπΒΡ‘≠“ρ «____ΓΘ
(2) Β―ι1-3÷–Θ§Ζ¥”Π…ζ≥…―θΤχΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ
Β―ι2ΘΚ
Θ®Χα≥ωΈ ΧβΘ© Β―ι1-3÷–»Φ…’ΒΡά·÷ρΈΣ ≤Ο¥Μαœ®ΟπΘΩ
Θ®≤¬œκ”κΦΌ…ηΘ©
I.ά·÷ρ»Φ…’…ζ≥…ΒΡΕΰ―θΜ·ΧΦΒΦ÷¬Τδœ®ΟπΓΘ
II.Ιΐ―θΜ·«βΖ÷Ϋβ ±Έϋ ’»»ΝΩΘ§ά·÷ρ÷ήΈßΒΡΈ¬Ε»ΫΒΒΆΒΫΉ≈ΜπΒψ“‘œ¬Θ§ΒΦ÷¬Τδœ®ΟπΓΘ
III.Ιΐ―θΜ·«βΖ÷Ϋβ≤ζ…ζΒΡΥ°ΈμΒΦ÷¬ά·÷ρœ®ΟπΓΘ
Θ®Ϋχ–– ‘―ιΘ©
–ρΚ≈ | 2-1 | 2-2 | 2-3 |
≤ΌΉς |
|
|
|
œ÷œσ | ”–Τχ≈ί≤ζ…ζΘ§ά·÷ρΜπ―φΈόΟςœ‘±δΜ·Θ§Έ¬Ε»…ΐΗΏ≤ΜΟςœ‘ | ”–ΫœΕύΤχ≈ίΚΆ…ΌΝΩΥ°Έμ≤ζ…ζΘ§ά·÷ρ»Φ…’ΗϋΆζΓΘΜπ―φΟςΝΝΘ§Έ¬Ε»…ΐΗΏΫœΟςœ‘ | ΨγΝ“Ζ¥”ΠΘ§”–¥σΝΩΤχ≈ίΚΆΥ°Έμ≤ζ…ζΘ§»Φ…’ΒΡά·÷ρœ®ΟπΘ§Έ¬Ε»…ΐΗΏΟςœ‘ |
Θ®Ϋβ Ά”κΫα¬έΘ©
(3)ΦΉΆ§―ß»œΈΣ≤¬œκI≤Μ≥…ΝΔΘ§ΥϊΒΡ“άΨί «____ΓΘ
(4)Ά®Ιΐ Β―ι―ι÷ΛΘ§Ω…“‘ΒΟ≥ω≤¬œκ____(Χν–ρΚ≈)≥…ΝΔΓΘ
(5)…œ ω Β―ι÷–Θ§Ρή÷ΛΟς―θΤχ”–÷ζ»Φ–‘ΒΡ Β―ιΦΑœ÷œσ «____ΓΘ
Θ®Ζ¥ΥΦ”κΤάΦέΘ©
Θ®6Θ©“άΨί…œ ω Β―ιΘ§»τ±Θ≥÷ Β―ι1-3÷–ά·÷ρ≤Μœ®ΟπΘ§Ω…≤…”ΟΒΡΖΫΖ®”–___ΓΘ
ΓΨΧβΡΩΓΩΡ≥ΤΖ≈ΤΩσ»ΣΥ°ΒΡ±ξ«©…œ±ξΟςΒΡΩσ»ΣΥ°÷ς“Σ≥…Ζ÷»γœ¬±μΥυ ΨΘ§«κΗυΨίœ¬±μΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Υ°÷ ÷ς“Σ≥…Ζ÷Θ®mgL©¹1Θ© | |||
ΤΪΙηΥαΘ®H2SiO3Θ© | 28.9ΓΪ42.9 | ο»Θ®Sr2+Θ© | 0.01ΓΪ0.32 |
ΧΦΥα«βΗυ | 173ΓΪ205 | ΗΤ | 5ΓΪ45 |
¬» | 1.0ΓΪ8.0 | ΡΤ | 45ΓΪ70 |
ΝρΥαΗυ | 16.06ΓΪ19.5 | ΦΊ | 0.5ΓΪ2.0 |
ΟΨ | 2.5ΓΪ7.5 | pH | 7.8Γά0.5 |
Θ®1Θ©ΝΫΗωΝρΥαΗυάκΉ”ΒΡΜ·―ßΖϊΚ≈ «_____ΓΘ
Θ®2Θ©ΧΦΥα«βΗΤΒΡΜ·―ß Ϋ «_____ΓΘ
Θ®3Θ©”ΟΫαΙΙ Ψ“βΆΦ±μ ΨC1©¹ΒΡΚΥΆβΒγΉ”≈≈≤ΦΘΚ_____ΓΘ
Θ®4Θ©ΤΪΙηΥα÷–Ιη‘ΣΥΊΒΡΜ·ΚœΦέ «_____ΓΘ