题目内容
【题目】氯化钠是日常生活的必需品,也是重要的化工原料.
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.
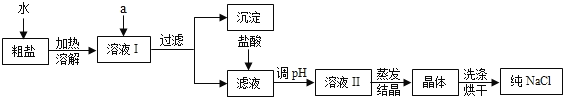
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、过量的______溶液、过量的______溶液
②在滤液中加盐酸的作用是_________________;验证盐酸已足量的方法及现象是_____________
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为______g.
①配制该溶液时所需要的玻璃仪器有______
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是______.
A.称量NaCl的操作错误,如左盘放了纸片而右盘未放
B.用量筒量取水时操作有误,如取水时俯视读数
C.烧杯中有水
D.氯化钠中混有杂质
【答案】BaCl2 Na2CO3 除去过量的NaOH和Na2CO3 取溶液II少许,滴加碳酸钠溶液,有气泡产生 1.8 烧杯、玻璃棒、量筒、胶头滴管 ACD
【解析】
(1)①要除去溶液I中的MgCl2、CaCl2、Na2SO4,所选试剂分别是氢氧化钠溶液,碳酸钠溶液和氯化钡溶液,依据题意要求,为了更好的把杂质除去,不带入新的杂质,所加溶液的顺序是氢氧化钠溶液,过量的BaCl2溶液,过量的Na2CO3溶液;
②由于过滤后的滤液中含有氢氧化钠和碳酸钠,所以要加入适量的盐酸,目的是除去过量的NaOH和Na2CO3,验证盐酸已足量的方法及现象是:取溶液II少许,滴加碳酸钠溶液,有气泡产生;
(2)氯化钠溶质的质量=溶液的质量×溶质的质量分数=200g×0.9%=1.8g;
①配制溶液需要的玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管;
②A、称量NaCl的操作错误,如左盘放了纸片而右盘未放,称取的氯化钠偏小,溶液溶质的质量分数低于0.9%,故正确;B、用量筒量取水时操作有误,如取水时俯视读数,水的实际体积偏小,溶液溶质的质量分数高于0.9%,故错误;C、烧杯中有水,溶液溶质的质量分数低于0.9%,故正确;D、氯化钠中混有杂质,氯化钠的实际质量偏小,溶液溶质的质量分数低于0.9%,故正确。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
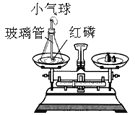
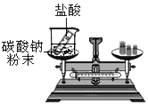
阳光试卷单元测试卷系列答案【题目】为了探究化学反应前后各物质的总质量是否发生改变,甲、乙、丙三组同学分别进行了下列实验,请根据图示回答问题。
[实验探究]甲、乙、丙三组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | 丙组 | |
实验装置 |
|
|
|
⑴甲组同学的实验现象是红磷燃烧,产生大量_______;小气球先膨胀,冷却后变得更瘪;反应后冷却到室温称量,天平的指针_______(填:“向右”、“向左”或“不”)偏转。在该实验中,玻璃管上系一个小气球的目的是________。该反应的化学方程式为_______。
⑵乙组同学的实验现象是铁钉表面有红色固体析出,溶液变为________色,反应前、后天平保持平衡。该反应的化学方程式为________。
⑶丙组同学的实验现象是反应剧烈,产生大量气泡,反应后天平不保持平衡。
[实验结论]化学反应前后各物质的总质量不发生改变。
[实验反思]在探究化学反应前后各物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在________装置中进行。