题目内容
【题目】水和溶液对人类的生产、生活具有重要的意义,请结合所学知识回答下列问题。
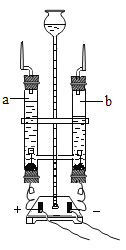
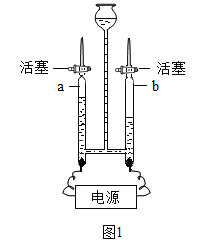
(1)如图1是电解水的装置,玻璃管a收集到的气体是_____,该实验说明水是由_____组成的。
(2)自来水厂净化水的过程中用到了大量的活性炭,活性炭的作用是_____,长期饮用硬度大的水不利于人体健康,生活中常用肥皂水来鉴别硬水和软水,并采用_____的方法来降低水的硬度,也能起到杀菌消毒的作用。
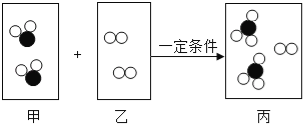
(3)如图2是甲、乙、丙三种固体物质(不含结晶水)在水中的溶解度曲线图。请结合图示回答下列问题。
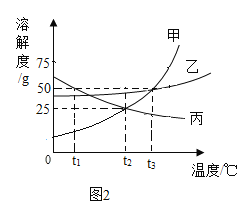
①溶解度随温度升高而减小的是物质是_____;
②t3℃时将50g甲物质放到50g水中充分溶解后所得溶液的质量是_____g;
③某温度下,将丙的饱和溶液转化为不饱和溶液的方法之一是_____;
④将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由小到大的顺序_____。
【答案】氧气 氢元素和氧元素 吸附色素和异味 煮沸 丙 75 增加溶剂 甲<丙<乙
【解析】
(1)水在通电条件下生成氢气和氧气,正氧负氢,体积比是1:2,所以,玻璃管a收集到的气体是氧气,故填写:氧气;
该实验产生氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,根据质量守恒定律的实质:化学反应前后,元素种类和数目不变可知,水是由氢元素和氧元素组成,故填写:氢元素和氧元素;
(2)活性炭疏松多孔,有吸附性能,可以吸附有色、有异味的物质,故填写:吸附色素和异味;
生活中常用煮沸的方法来降低水的硬度,故填写:煮沸;
(3)①由图可知,横坐标表示温度,纵坐标表示溶解度,溶解度随温度升高而减小的曲线是丙曲线,因此,溶解度随温度升高而减小的是物质是丙,故填写:丙;
②由图可知,t3℃时,甲物质的溶解度为50g,即100g水可溶解50g甲物质达到饱和,因此,50g水可溶解25g甲物质达到饱和,得到的溶液质量是50g+25g=75g,故填写:75;
③某温度下,将丙的饱和溶液转化为不饱和溶液的方法增加溶剂,故填写:增加溶剂;
④t1℃时,乙物质的溶解度最大,丙物质的溶解度次之,甲物质的溶解度最小,甲、乙物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,所以将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,甲、乙物质会析出晶体,丙物质不会析出晶体,应该按照t3℃时的溶解度计算,所以所得溶液的溶质质量分数:甲<丙<乙,故填写:甲<丙<乙。

 名校课堂系列答案
名校课堂系列答案