题目内容
【题目】根据下列实验装置图,回答有关问题。
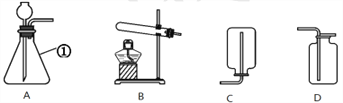
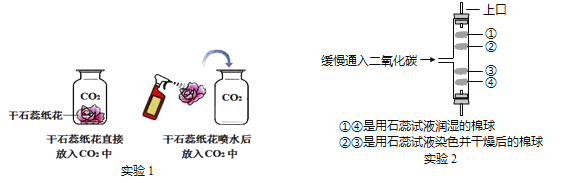
(1)图中标有①的仪器名称是_____________。
(2)实验室制取二氧化碳的化学方程式是__________________________________, 收集二氧化碳时,证明集气瓶已充满二氧化碳的方法是_______________________________________,集满二氧化碳的集气瓶应_____________(填“正”或“倒”)放在桌面上。
(3)实验室加热氯酸钾和二氧化锰制取氧气的化学方程式是_______________________________________,其中二氧化锰起_____________作用, 应选择的发生装置是_____________(填字母) 。
(4) 49g 稀硫酸与足量锌反应生成 0.2g 氢气,该稀硫酸的溶质质量分数是多少_____________?
(写出解题过程)
【答案】 锥形瓶 CaCO3 + 2HCl=CaCl2 + H2O + CO2↑ 将燃着的木条放在集气瓶口, 若燃着木条熄灭,则已满 正 2KClO3![]() 2KCl+3O2↑ 催化 B
2KCl+3O2↑ 催化 B
(4) 解: 设 H2SO4 的质量为 x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
98︰2=x︰0.2g x=9.8g
(9.8g÷49g) ×100% = 20%
答:该稀硫酸溶质质量分数是 20%。
【解析】(1)图中标有①的仪器名称是锥形瓶。
(2)实验室常用石灰石和稀盐酸反应制取二氧化碳,化学方程式是CaCO3 + 2HCl=CaCl2 + H2O + CO2↑, 收集二氧化碳时,证明集气瓶已充满二氧化碳的方法是将燃着的木条放在集气瓶口, 若燃着木条熄灭,则已满 ;二氧化碳的密度比空气大,集满二氧化碳的集气瓶应正放在桌面上。(3)实验室加热氯酸钾和二氧化锰制取氧气的化学方程式是2KClO3 ![]() 2KCl+3O2↑,二氧化锰能改变氯酸钾的反应速率,而本身的质量和化学性质在反应前后不变,是氯酸钾分解的催化剂。其作用是催化作用,选择发生装置需考虑是因素是,反应物的状态和反应条件。加热固体制取气体,发生装置为A。
2KCl+3O2↑,二氧化锰能改变氯酸钾的反应速率,而本身的质量和化学性质在反应前后不变,是氯酸钾分解的催化剂。其作用是催化作用,选择发生装置需考虑是因素是,反应物的状态和反应条件。加热固体制取气体,发生装置为A。
(4)设稀硫酸的溶质质量为x,
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
98︰2=x︰0.2g x=9.8g
(9.8g÷49g) ×100% = 20%
答:该稀硫酸溶质质量分数是 20%。

【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
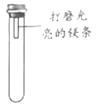
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________
【题目】右下图中, “—”表示相连的物质间在一定条件下可以反应, “→”表示在一定条件下丁可以转化为乙。下面四组选项中符合右下图要求的是( )
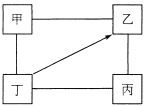
甲 | 乙 | 丙 | 丁 | |
A | H2SO4 | Ba(NO3)2 | NaOH | Na2CO3 |
B | CaCl2 | K2CO3 | Ca(OH)2 | HCl |
C | C | H2O | CO2 | O2 |
D | Al | CuSO4 | Zn | H2SO4 |
A. A B. B C. C D. D