题目内容
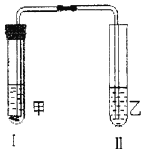
【题目】为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为![]() 的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通入一会儿氮气。
的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通入一会儿氮气。![]() 样品中其他成分不与稀硫酸反应,氮气不参与任何反应
样品中其他成分不与稀硫酸反应,氮气不参与任何反应![]()
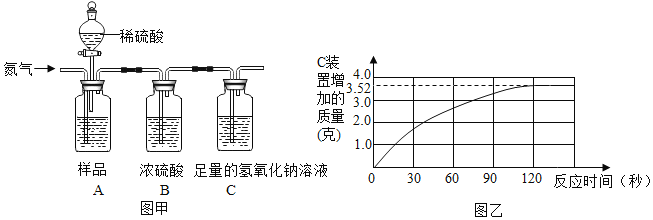
(1)实验前,先往A装置通入一会儿氮气的目的是______。
A、避免容器中的空气对实验干扰
B、检验装置的气密性
C、将反应产生的![]() 气体全部赶到C装置中
气体全部赶到C装置中
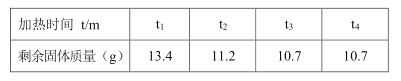
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?________![]()
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由______。
【答案】A 84.8% 浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应
【解析】
(1)实验前,先往A装置通入一会儿氮气的目的是除去装置中的二氧化碳,避免容器中的空气对实验干扰,故选A;
(2)设碳酸钠质量为x。
由表中数据控制,反应生成二氧化碳的质量是![]() ,
,

![]()
![]()
则该食用纯碱中碳酸钠的质量分数是:![]() ;
;
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,是因为浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。