题目内容
取铜和氧化铜的混合物10g,加入一定量的稀硫酸,测得恰好完全反应后,得到溶质质量分数为16%的溶液100g.计算:(1)固体混合物中铜的质量分数.
(2)稀硫酸的溶质质量分数.
分析:首先根据溶液的质量和溶质的质量分数计算出溶质硫酸铜的质量,然后根据化学方程式求出反应的氧化铜的质量和硫酸的质量,
其次根据质量守恒定律由溶液的总质量减去反应的氧化铜的质量求出加入的稀硫酸的质量.
最后求出各物质的质量分数.
其次根据质量守恒定律由溶液的总质量减去反应的氧化铜的质量求出加入的稀硫酸的质量.
最后求出各物质的质量分数.
解答:解:反应后所得溶液中的溶质为硫酸铜,质量为16%×100g=16g
设参加反应的氧化铜的质量为x,参加反应的硫酸质量为y
CuO+H2SO4═CuSO4+H2O
80 98 160
x y 16g
=
=
解之得:x=8g,y=9.8g
所以原混合物中铜的质量为10g-8g=2g
(1)原混合物中铜的质量分数=
×100%=20%,
(2)加入的稀硫酸的质量为所得溶液的质量减去氧化铜的质量,即100g-8g=92g
所以稀硫酸的溶质质量分数=
×100%=10.7%
答:(1)原混合物中铜的质量分数20%,
(2)稀硫酸的溶质质量分数10.7%.
设参加反应的氧化铜的质量为x,参加反应的硫酸质量为y
CuO+H2SO4═CuSO4+H2O
80 98 160
x y 16g
| 80 |
| x |
| 98 |
| y |
| 160 |
| 16g |
解之得:x=8g,y=9.8g
所以原混合物中铜的质量为10g-8g=2g
(1)原混合物中铜的质量分数=
| 2.0g |
| 10g |
(2)加入的稀硫酸的质量为所得溶液的质量减去氧化铜的质量,即100g-8g=92g
所以稀硫酸的溶质质量分数=
| 9.8g |
| 92g |
答:(1)原混合物中铜的质量分数20%,
(2)稀硫酸的溶质质量分数10.7%.
点评:解答本题关键要审题,要分清数据之间的关系,入所得溶液的质量不包括没有参加反应的铜,同时要注意解题的规范性,以免失分.

练习册系列答案
相关题目
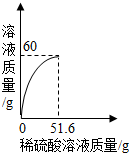 (2013?湖北)小丽同学取铜和氧化铜的混合物mg置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示.求:
(2013?湖北)小丽同学取铜和氧化铜的混合物mg置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示.求: