题目内容
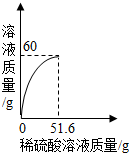 (2013?湖北)小丽同学取铜和氧化铜的混合物mg置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示.求:
(2013?湖北)小丽同学取铜和氧化铜的混合物mg置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示.求:(1)mg混合物中,氧化铜的质量是
8.4
8.4
克;(2)当加入51.6g稀硫酸溶液时恰好完全反应,此时溶液中溶质的质量分数.
分析:(1)根据氧化铜和硫酸反应生成硫酸铜和水,而铜不和硫酸反应,所以溶液质量增加的就是氧化铜的质量进行解答;
(2)根据溶液中溶质的质量分数=
×100%进行解答.
(2)根据溶液中溶质的质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)氧化铜和硫酸反应生成硫酸铜和水,而铜不和硫酸反应,所以溶液质量增加的就是氧化铜的质量,所以mg混合物中,氧化铜的质量=60g-51.6g=8.4g;故填:8.4;
(2)设当加入51.6g稀硫酸溶液时恰好完全反应生成硫酸铜的质量为x.
H2SO4+CuO═CuSO4+H2O
80 160
8.4g x
=
x=16.8g
溶液中溶质的质量分数=
×100%=28%
答:溶液中溶质的质量分数28%.
(2)设当加入51.6g稀硫酸溶液时恰好完全反应生成硫酸铜的质量为x.
H2SO4+CuO═CuSO4+H2O
80 160
8.4g x
| 80 |
| 8.4g |
| 160 |
| x |
x=16.8g
溶液中溶质的质量分数=
| 16.8g |
| 60g |
答:溶液中溶质的质量分数28%.
点评:利用烧杯中溶液增加的质量的分析,判断反应进行情况,此为此问题解答的基础.

练习册系列答案
相关题目
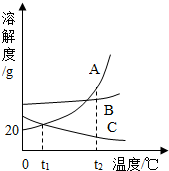 (2013?湖北)溶液在生产和生活中有着重要意义.如图A、B、C三种固体物质的溶解度曲线请回答下列相关问题:
(2013?湖北)溶液在生产和生活中有着重要意义.如图A、B、C三种固体物质的溶解度曲线请回答下列相关问题: