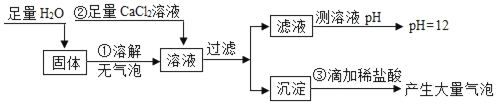
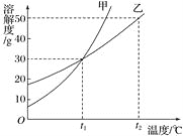
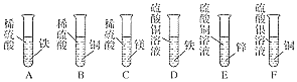
题目内容
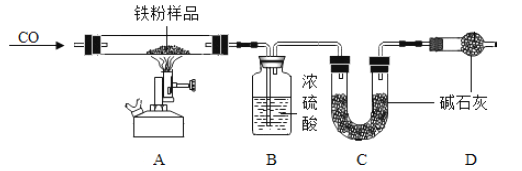
【题目】某同学模拟工业炼铁的原理,用如图所示装置进行实验.取8g氧化铁,通入足量一氧化碳,充分反应后,冷却,将玻璃管中的固体移入盛有49g硫酸溶液的烧杯中,恰好完全反应.
(1)该同学首先按如图所示装置装配好仪器,检查了气密性并装好药品,接下来的操作是___________(只写一步即可).
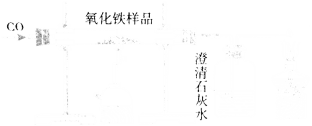
(2)计算硫酸溶液的溶质质量分数(要求写出计算推理过程).
【答案】(1)先通一段时间的一氧化碳
(2)20%
【解析】(1)通入一氧化碳,其目的是排尽玻璃管内的空气,防止加热时引起爆炸;(2)根据一氧化碳还原氧化铁的原理书写化学方程式,由该化学方程式找到氧化铁和铁单质间的数量关系可以求得单质铁的质量;然后由铁与稀硫酸反应的化学方程式找出铁与稀硫酸间的数量关系.
(1)先通一段时间的一氧化碳
(2)解:设8g氧化铁完全反应后生成铁的质量为x.
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
8g x
160︰112=8g︰x
x=5.6g
设5.6g铁完全反应消耗硫酸的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g y
56︰98=5.6g︰y
y=9.8g
硫酸溶液的溶质质量分数为:9.8g/49g×100%=20%
答:硫酸溶液的溶质质量分数为20%.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
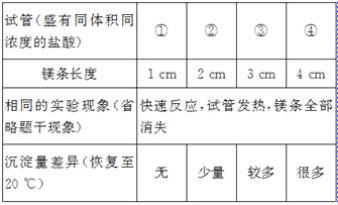
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |