题目内容
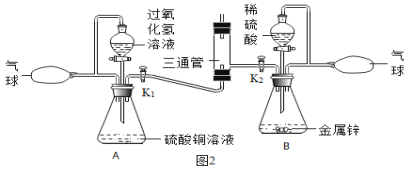
【题目】某化学兴趣小组为探究某氢氧化钠固体样品变质程度进行了如图1所示的实验,请计算:

(1)生成二氧化碳的质量为______g。
(2)求变质后的固体中含碳酸钠的质量_____(写出计算过程)。
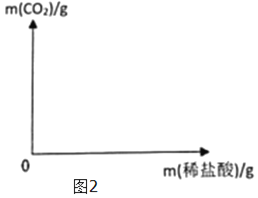
(3)请在坐标图(图2)中画出实验过程中产生CO2的质量随滴加盐酸质量的变化曲线(表明横纵坐标的相应数值)_____。
(4)该氢氧化钠固体的变质程度为(氢氧化钠变质程度指已变质的氢氧化钠占变质前氢氧化钠的质量分数)______,因此氢氧化钠应______保存。
【答案】2.2 5.3g  50% 密封
50% 密封
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钠的质量以及对应的变质前的氢氧化钠的质量和消耗的盐酸溶液溶液的质量,进而确定原样品中的氢氧化钠的质量以及开始有气体生成时消耗的盐酸的质量。
解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为9.3g+50g+50g-107.1g=2.2g;
(2)设碳酸钠的质量为x,对应的变质前的氢氧化钠的质量为y,消耗的盐酸溶液溶液的质量为z,
根据2NaOH+CO2=Na2CO3+H2O和Na2CO3+2HCl═2NaCl+H2O+CO2↑可得:
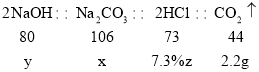
![]() x=5.3g,
x=5.3g,
![]() y=4g,
y=4g,
![]() z=50g,
z=50g,
则氢氧化钠的质量为9.3g-5.3g=4g;
设氢氧化钠消耗的稀盐酸质量为a,
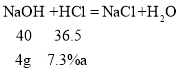
![]()
a=50g,
所以恰好完全反应时消耗的盐酸的质量为100g;
(3)由此可得,实验过程中产生CO2的质量随滴加盐酸质量的变化曲线为:

(4)该氢氧化钠固体的变质程度为![]() ×100%=50%;因此氢氧化钠应密封保存。
×100%=50%;因此氢氧化钠应密封保存。

【题目】请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm3)
实验操作 | 实验结果 |
取100ml水,加入25g硝酸钾,搅拌,恢复至20℃ | 全部溶解,得溶液① |
再加wg硝酸钾,搅拌,恢复到20℃ | 恰好饱和,得溶液② |
再加25g硝酸钾,搅拌,恢复到20℃ | 得溶液③ |
加热 | 全部溶解,得溶液④ |
冷却至20℃ | 析出晶体,得溶液⑤ |
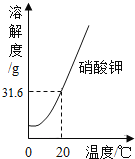
(1)w的值为___;
(2)一定属于不饱和溶液的是___;(填序号,下同)
(3)溶质的质量分数一定相等的是___.