题目内容
【题目】FeSO47H2O是一种重要的食品和饲料添加剂.某工业废渣主要成分是Fe2O3 , 还含有CaCO3和SiO2(既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO47H2O的流程如图1: 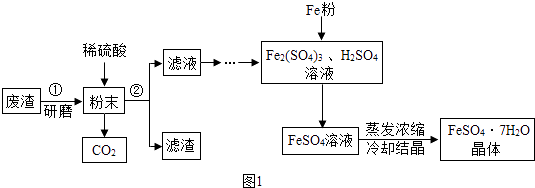
请根据流程图回答下列问题:
(1)稀硫酸与粉末中的氧化铁反应的化学方程式为
(2)操作②所需要的玻璃仪器是:烧杯、玻璃棒和 .
(3)经测定,滤渣中只含有CaSO4和SiO2 , 你认为实验室(填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳.
(4)Fe与Fe2(SO4)3反应的化学方程式为 .
(5)硫酸亚铁的溶解度曲线如图2.待结晶完毕后,滤出晶体,用少量冰水洗涤2﹣3次.用冰水洗涤的目的是: Ⅰ除去晶体表面附着的杂质;
Ⅱ . 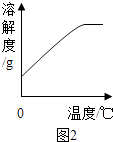
【答案】
(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
(2)漏斗
(3)能
(4)Fe+Fe2(SO4)3═3FeSO4
(5)用冰水洗涤可降低洗涤过程中FeSO4?7H2O的损耗
【解析】解:(1)稀硫酸与粉末中的氧化铁反应,生成硫酸铁和水,其反应的化学方程式为:Fe2O3+2H2SO4═Fe2(SO4)3+3H2O;所以答案是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(2)由题目中图可以看出步骤②用来分离固体和液体,获得滤液和滤渣,所以这个步骤是过滤;过滤时需用到的仪器有:烧杯、玻璃棒和漏斗;所以答案是:漏斗;(3)工业废渣主要成分是Fe2O3 , 还含有CaCO3和SiO2(既不溶于水也不溶于稀硫酸),加入稀硫酸后,题目中指出:“经测定,滤渣中只含有CaSO4和SiO2;”说明废渣中的碳酸钙已经完全和稀硫酸反应,生成了二氧化碳气体,所以答案是:能;(4)由图可知:Fe与Fe2(SO4)3反应生成FeSO4 , 反应物是Fe和Fe2(SO4)3 , 生成物是FeSO4 , 故反应的化学方程式为:Fe+Fe2(SO4)3═3FeSO4; 所以答案是:Fe+Fe2(SO4)3═3FeSO4;(5)硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,用冰水洗涤的目的是一、除去晶体表面附着的溶于水杂质,二、冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失.
所以答案是:用冰水洗涤可降低洗涤过程中FeSO47H2O的损耗.
【考点精析】掌握过滤操作的注意事项和固体溶解度曲线及其作用是解答本题的根本,需要知道过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案