题目内容
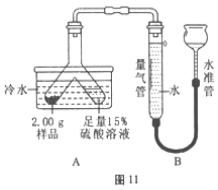
【题目】兴趣组同学用木炭粉还原氧化铜一段时间后,发现剩余固体中有一些黑色粉末。甲同学取少量剩余固体加入5%的H2O2溶液中,发现有大量气泡迅速放出,于是兴趣小组同学进行了以下的探究

(1)乙同学取用少量剩余固体,在空气中灼烧,并在上方罩一个内壁涂有石灰水的烧杯(如图)进行实验,发现烧杯内壁的澄清石灰水不变浑浊,证明剩余固体中不含有__________。
(2)丙同学又进行了如下探究:
【提出问题】剩余固体的哪种物质加速了过氧化氢的分解,是过氧化氢溶液反反应的催化剂?

【猜 想】猜想Ⅰ.铜是H2O2溶液分解的催化剂。
猜想Ⅱ.氧化铜是H2O2溶液分解的催化剂。
【实验与判断】实验过程如下:
A.丙同学进行如右图所示实验,发现加入铜粉后几乎没有变化,证明猜想Ⅰ______(选填“成立”或“不成立”)。实验①的作用是______。
B.丙同学又用天平称量0.5g氧化铜,取5mL5%的过氧化氢溶液于试管中, 又进行如下实验:
实验 步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 |
| ③的现象是 _________,木条复燃。 | 猜想Ⅱ成立 |
步骤二 | 步骤一中的③试管内的物质过滤,得到的固体烘干,称量。 | 质量为0.5g。 | |
步骤三 | 步骤②得到的固体,加入到盛5%的过氧化氢溶液的试管中,把带火星的木条伸入试管中。 | 有气泡产生, ________。 |
步骤三的目的是__________________。过氧化氢能被氧化铜催化分解放出氧气的化学化学方程式为____________________。
【拓展】除了催化剂能改变化学反应的速率,你猜想还有那些因素也可能影响化学反应的速率_______________________(写一个即可)。
【答案】 C(或炭、木炭粉) A.不成立 与②对照 B.有气泡迅速放出 带火星的木条复燃 证明CuO在反应前后化学性质没有改变 2H2O2![]() 2H2O+O2↑ 反应物的浓度(或温度、反应物的接触面积等)
2H2O+O2↑ 反应物的浓度(或温度、反应物的接触面积等)
【解析】(1)二氧化碳气体能使澄清的石灰水变浑浊,在空气中灼烧,并在上方罩一个内壁涂有石灰水的烧杯(如右图)进行实验,发现烧杯内壁的澄清石灰水不变浑浊,说明没有二氧化碳生成,证明剩余固体中不含有炭;
(2)【实验与判断】A、将铜粉放入过氧化氢溶液中,发现加入铜粉后几乎没有变化,证明铜不是H2O2溶液分解的催化剂。实验①的作用是与②对照,观察反应的现象。
B、步骤一木条复燃说明产生了大量的氧气,所以试管中有气泡迅速放出;
步骤三催化剂在反应前后质量和化学性质都不变,所以步骤②得到的固体,加入到盛5%的过氧化氢溶液的试管中,把带火星的木条伸入试管中,带火星的木条复燃,试管中有气泡迅速放出;所以步骤三的目的是证明CuO在反应前后化学性质没有改变,过氧化氢能被氧化铜催化分解放出氧气的化学化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
【拓展】
影响化学反应的速率因素有:温度、反应物浓度、接触面积和催化剂等。