题目内容
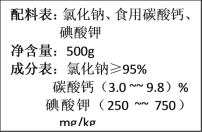
【题目】下图为某加钙食盐包装袋上的标签,通过下列方法检查该食盐中钙元素的含量:往装有稀盐酸的小烧杯(总质量为200.0g)加入30.0g该盐样品,充分反应后,无固体剩余。反应后烧杯和烧杯中剩余物的总质量为228.9g。试计算:
(1)反应过程中产生的CO2质量为_______g;
(2)通过计算说明该食盐中碳酸钙含量是否达标______?(计算结果保留到0.01%)
【答案】1.1克 8.33%,合格
【解析】
(1)反应前物质的总质量是200.0g+30.0g=230.0g,根据质量守恒定律,反应后物质的总质量也应该是230.0g,但是实际上只有228.9g,相差230.0g-228.9g=1.1g,由题可知,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,实验在开放体系中进行,所以差值1.1g就是生成的二氧化碳的质量,故填1.1;
(2)由前分析可知30.0g样品充分反应生成二氧化碳1.1g,根据化学方程式计算出样片中碳酸钙的质量,再算出样品中碳酸钙的质量分数,和标签比较,假设30.0g食盐样品中含碳酸钙的质量为X,

![]() =
= ![]()
解得X=2.5g,那么食盐中碳酸钙的质量分数=![]() ×100≈8.33%,介于成分表中碳酸钙含量3.0%到9.8%之间,碳酸钙含量合格,故填8.33%,合格。
×100≈8.33%,介于成分表中碳酸钙含量3.0%到9.8%之间,碳酸钙含量合格,故填8.33%,合格。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目