题目内容
(3分)一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成CO、CO2、H2O的总质量为10.4 g,若其中H2O的质量为5.4 g,计算生成CO的质量。
2.8 g
试题分析:解:设生成CO的CH4的质量为x,生成CO2的CH4的质量为y。
CH4 ~ CO ~ 2H2O CH4 ~ CO2 ~ 2H2O
16 28 36 16 44 36
x
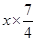
 y
y 
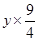
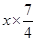 +
+ = 5 g
= 5 g +
+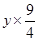 = 5.4 g
= 5.4 gx=1.6 g
1.6 g×
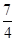 =2.8 g
=2.8 g解法二:
甲烷中的C:H的质量比为3:1
生成物中氧元素的质量:10.4 g-5.4 g×
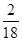 ×4=8 g
×4=8 g设一氧化碳的质量为x,则:
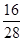 ×x+( 10.4 g-5.4 g-x)×
×x+( 10.4 g-5.4 g-x)×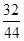 +5.4 g×
+5.4 g×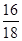 =8 g
=8 g x=2.8 g
解法三:碳元素的质量为1.8 g
设一氧化碳的质量为x,则:
 ×x+(10.4 g-5.4 g-x)×
×x+(10.4 g-5.4 g-x)×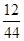 =1.8 g
=1.8 gx=2.8 g
点评:化学反应都遵循质量守恒定律,各反应物之间都存在固定的质量关系,根据这些质量关系,我们可以计算物质的具体质量。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
