题目内容
(2009?吴中区一模)海水中有非常丰富的化学资源,从海水中可提取多种化工原料.如图是某工厂对海水资源综合利用的示意图.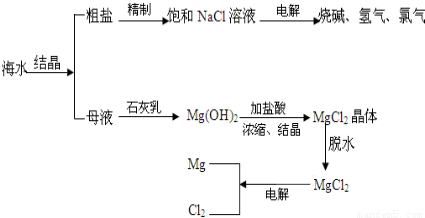
(1)粗盐中含有泥砂、CaCl2、MgCl2等杂质.实验室用粗盐配制不含杂质的饱和NaCl溶液,做了以下实验:
步骤一:除去泥砂.应进行的操作是:溶解、______.
步骤二:除去CaCl2和MgCl2.加入NaOH溶液,使MgCl2转化为Mg(OH)2,加入Na2CO3溶液,使CaCl2转化为CaCO3,为了除尽杂质,所加的NaOH和Na2CO3都需过量,在过滤除去Mg(OH)2和CaCO3沉淀后,应再加入适量的______(填一种试剂名)以除去过量的NaOH和Na2CO3.
(2)电解饱和食盐水后得到的溶液中含有NaOH和NaCl两种溶质,为了得到NaOH溶液,可用蒸发结晶的办法除去NaCl,这是因为______.
(3)海水提取粗盐后的母液中含KCl、MgCl2、NaCl等溶质,加入石灰乳后可得Mg(OH)2,而制石灰乳的原料可利用海滩上的贝壳(主要成分是CaCO3),写出由贝壳制取石灰乳有关反应的化学方程式:
①______ CaO+CO2↑
【答案】分析:(1)根据泥沙不溶于水而其他盐均溶于水得出结论;所加过量的NaOH和Na2CO3用盐酸除去,既不引入杂质离子,又达到除杂的效果;
(2)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(3)碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水生成氢氧化钙;
(4)在两条生产流程中,粗盐和母液中有大量的杂质存在,所以必须进行除杂处理,然后电解得到相应的产物.
解答:解:(1)根据泥沙不溶于水而其他盐均溶于水,故采用先溶解后过滤的方法;用盐酸除去过量的NaOH和Na2CO3,既不引入杂质离子,又达到除杂的效果;
(2)因为氯化钠的溶解度随温度变化不大,,所以可以采用蒸发溶剂法结晶,除去氢氧化钠中的氯化钠;
(3)CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2;
CaO+CO2↑,CaO+H2O=Ca(OH)2;
(4)粗盐和母液中有大量的杂质存在,所以必须进行除杂处理.
故答案为:(1)过滤、盐酸
(2)氯化钠的溶解度随温度变化不大
(3)CaCO3 CaO+CO2↑;CaO+H2O=Ca(OH)2
CaO+CO2↑;CaO+H2O=Ca(OH)2
(4)除杂.
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握.
(2)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(3)碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水生成氢氧化钙;
(4)在两条生产流程中,粗盐和母液中有大量的杂质存在,所以必须进行除杂处理,然后电解得到相应的产物.
解答:解:(1)根据泥沙不溶于水而其他盐均溶于水,故采用先溶解后过滤的方法;用盐酸除去过量的NaOH和Na2CO3,既不引入杂质离子,又达到除杂的效果;
(2)因为氯化钠的溶解度随温度变化不大,,所以可以采用蒸发溶剂法结晶,除去氢氧化钠中的氯化钠;
(3)CaCO3
 CaO+CO2↑,CaO+H2O=Ca(OH)2;
CaO+CO2↑,CaO+H2O=Ca(OH)2;(4)粗盐和母液中有大量的杂质存在,所以必须进行除杂处理.
故答案为:(1)过滤、盐酸
(2)氯化钠的溶解度随温度变化不大
(3)CaCO3
 CaO+CO2↑;CaO+H2O=Ca(OH)2
CaO+CO2↑;CaO+H2O=Ca(OH)2(4)除杂.
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握.

练习册系列答案
相关题目
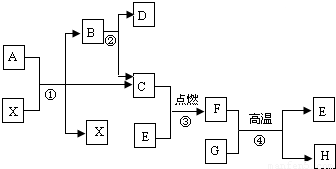
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O