题目内容
(2009?吴中区一模)某课外活动小组的同学利用下列装置探究CO2的实验室制法.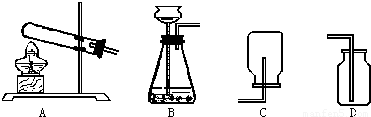
(1)甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置和收集装置依次是______(填序号),发生反应的化学方程式是______.
若甲同学选用的酸是浓盐酸,则制得的气体通入澄清石灰水时产生的现象可能是______.
(2)加热固体NaHCO3或固体NH4HCO3也能产生CO2,例如加热NaHCO3固体的化学方程式为:2NaHCO3
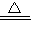 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O固体NH4HCO3受热分解的条件的反应我们已学过,由受热分解的条件可知NH4HCO3、Na2CO3、NaHCO3热稳定性是______>______>______.
(3)乙利用加热NaHC03的方法制取CO2,应选用的发生装置应是图中的______(填序号),他不选用加热NH4HCO3制取CO2的原因是______.
【答案】分析:(1)根据发生装置和收集装置的选择方法和方程式的写法来考虑;根据浓盐酸的挥发性考虑实验现象;(2)受热易分解的属于稳定性差的,受热不易分解的属于稳定性强的;(3)根据发生装置的选择方法考虑,再根据碳酸氢铵受热分解的产物来寻找原因.
解答:解:(1)发生装置的选择与反应物的状态有关,固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集;由于制取二氧化碳用大理石与稀盐酸反应,属于固体和液体,所以不需要加热,二氧化碳能溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集;实验室制取二氧化碳的反应物是碳酸钙和盐酸,生成物是氯化钙、水、二氧化碳,用观察法配平即可;因为浓盐酸具有较强的挥发性,使制得的二氧化碳不纯混有氯化氢,进入澄清石灰水中时溶于水形成盐酸,会与碳酸钙反应,所以看不到沉淀;
(2)由于NH4HCO3略微受热就能分解,NaHCO3受热一段时间才分解,碳酸钠受热根本就不分解,所以他们的稳定性越来越强;
(3)根据题给信息加热NaHC03的方法制取CO2,可知反应需要加热,所以选择A装置;不选用加热NH4HCO3制取CO2的原因是碳酸氢铵受热分解时还产生了氨气,所以会使制得的二氧化碳不纯.
故答案为:(1)BD;CaCO3+2HCl═CaCl2+H2O+CO2↑;可能无明显现象,或者有少许沉淀生成;(2)Na2CO3、NaHCO3、NH4HCO3;(3)A;产生的气体是混合气体,还需要分离,增加了操作难度.
点评:通过回答本题知道了收集装置的选择方法是根据气体的密度和在水中的溶解性有关,发生装置的选择与反应物的状态有关;受热易分解的物质属于稳定性差的,受热不易分解的物质属于稳定性强的.
解答:解:(1)发生装置的选择与反应物的状态有关,固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集;由于制取二氧化碳用大理石与稀盐酸反应,属于固体和液体,所以不需要加热,二氧化碳能溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集;实验室制取二氧化碳的反应物是碳酸钙和盐酸,生成物是氯化钙、水、二氧化碳,用观察法配平即可;因为浓盐酸具有较强的挥发性,使制得的二氧化碳不纯混有氯化氢,进入澄清石灰水中时溶于水形成盐酸,会与碳酸钙反应,所以看不到沉淀;
(2)由于NH4HCO3略微受热就能分解,NaHCO3受热一段时间才分解,碳酸钠受热根本就不分解,所以他们的稳定性越来越强;
(3)根据题给信息加热NaHC03的方法制取CO2,可知反应需要加热,所以选择A装置;不选用加热NH4HCO3制取CO2的原因是碳酸氢铵受热分解时还产生了氨气,所以会使制得的二氧化碳不纯.
故答案为:(1)BD;CaCO3+2HCl═CaCl2+H2O+CO2↑;可能无明显现象,或者有少许沉淀生成;(2)Na2CO3、NaHCO3、NH4HCO3;(3)A;产生的气体是混合气体,还需要分离,增加了操作难度.
点评:通过回答本题知道了收集装置的选择方法是根据气体的密度和在水中的溶解性有关,发生装置的选择与反应物的状态有关;受热易分解的物质属于稳定性差的,受热不易分解的物质属于稳定性强的.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目