题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大作用.
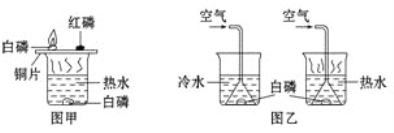
(1)硝酸在工业生产中有广泛的应用,工业上制取硝酸的关键反应为:4NH3+5O2![]() 4NO+6R,其中R的化学式为 ______ ;
4NO+6R,其中R的化学式为 ______ ;
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”、“>”或“<”)m1 ______ m2;
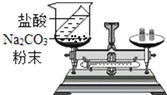
(3)如图所示装置,将烧杯放在天平上用砝码平衡,然后倾斜烧杯使盐酸与碳酸钠粉末接触,一段时间后再把烧杯放在天平上称量,发现天平的指针偏右,其原因是 ______ ,由这个实验推测:要验证质量守恒定律,有气体生成时,实验环境应在 ______ (开放、密闭)体系中进行.
【答案】 H2O = 反应产生气体质量未计量 密闭
【解析】(1)化学反应前后各种原子个数相等,反应前有4N、12H、10O,反应后(R除外),有4N、4O,故6R中有12H、6O,所以R的化学式为H2O。(2)化学反应遵守质量守恒定律,该反应无气体参加或生成,故反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量与原来相等。(3)反应未在密闭容器中进行,Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,反应产生气体逸散到空气中去了,气体质量未计量。验证质量守恒定律,有气体参加或生成时,应在密闭体系中进行。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。