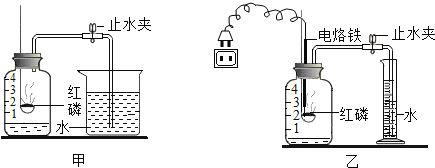
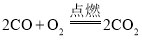��Ŀ����
����Ŀ���Ͼɵ�·������Ҫ�������ϡ�ͭ������Sn���ȣ�Ϊʵ�ֶ�������ɫ���գ�������¹������̣�

��֪��Sn+SnCl4��2SnCl2
��1����������_____��������������
��2��SnCl2����Ԫ�صĻ��ϼ���_____��
��3��ͭ�Ľ�����Ա�����_____���ǿ����������������A��һ�����еĽ���Ԫ����_____��
��4��д��������������Ӧ�Ļ�ѧ����ʽ_____���䷴Ӧ������_____��
��5�������ֱ�ӷ��շϾɵ�·����ս������ù��յ���Ҫ�ŵ���_____���ش�һ�㣩��
���𰸡��л��� +2�� �� ͭ 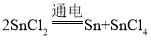 �ֽⷴӦ �����˻�����Ⱦ�������˽�����Դ��
�ֽⷴӦ �����˻�����Ⱦ�������˽�����Դ��
��������
��1�������Ǻ�̼�������Ҿ����л�������ʣ����������л��
��2��SnCl2����Ԫ��Ϊ��1�ۣ����ݻ��������������ϼ۵Ĵ�����Ϊ��ɵã���Ԫ�صĻ��ϼ���+2�ۣ�
��3���ڽ����˳���У�������֮ͭǰ��ͭ�Ľ�����Ա���������ͭ�������Ȼ�����Һ���ܷ�Ӧ��������Һ��û��ͭԪ�أ������A��һ�����еĽ���Ԫ����ͭ��
��4���������SnCl2��ͨ�����������������SnCl4�����Է�����Ӧ�Ļ�ѧ����ʽ  ���÷�Ӧ����һ�����ʷֽ������������ʣ����ڷֽⷴӦ��
���÷�Ӧ����һ�����ʷֽ������������ʣ����ڷֽⷴӦ��
��5�������ֱ�ӷ��շϾɵ�·����ս������ù��յ���Ҫ�ŵ��� �����˻�����Ⱦ�������˽�����Դ�ȡ�

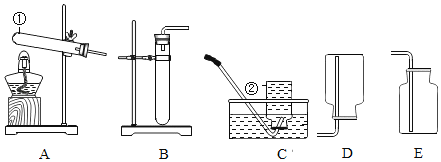
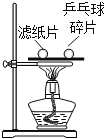
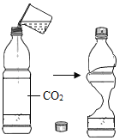
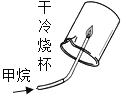
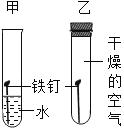
����Ŀ������ͼʾ���ĸ�ʵ�飬��������ó��Ľ��ۣ���ȷ���ǣ�������
|
|
|
|
A����ȼ��ȼ����Ҫ�¶ȴﵽ�Ż�� | B��CO2��H2O��Ӧ����H2CO3 | C��CH4ȼ������CO2��H2O | D����������ֻ����H2O�Ӵ� |
A. AB. BC. CD. D