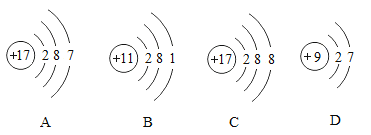
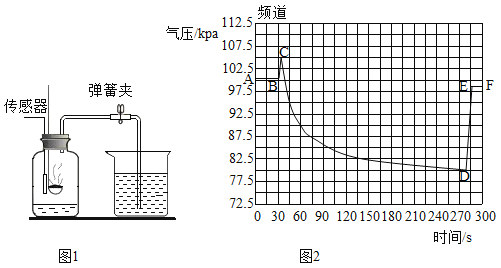
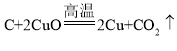题目内容
【题目】实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定这瓶样品中氢氧化钠的质量分数,做如下实验:现取 Wg 样品放入盛有足量水的烧杯中(充分溶解),向烧杯中逐滴加入200g一定溶质质量分数的稀盐酸。实验数据如图1所示,试分析计算回答:

(1)恰好完全反应时,产生气体的质量是_____g,与 P 点对应的溶液溶质是_____。
(2)Wg 样品中氢氧化钠的质量分数是______?(精确到 0.1%)
(3)在往烧杯内逐滴加入稀盐酸的过程中,烧杯中溶液各个量随盐酸质量的变化图象如图2所示,则正确的有_____(可多选)。
【答案】2.2 NaOH和Na2CO3以及NaCl 69.4% CD
【解析】
(1)由图可知产生气体的质量是 2.2g,P点没有生成气体,且一直到150g稀盐酸时才有气体生成,说明此时氢氧化钠没有完全反应,而碳酸钠尚未开始反应,所以与 P 点对应的溶液溶质是剩余的NaOH和尚未参加反应的Na2CO3和生成的NaCl;
(2)设稀盐酸的质量分数为x,设碳酸钠的质量为y,计算过程如下:
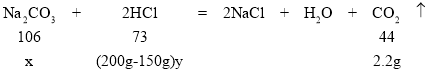 ,
,
![]() ,
,
解得x=5.3g,y=7.3%;
设氢氧化钠的质量为z,计算过程如下:
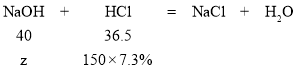 ,
,
![]() ,解得z=12g;
,解得z=12g;
Wg 样品中氢氧化钠的质量分数是![]() ;
;
(3)A、图中pH变小,但是稀盐酸过量后pH应该小于7;错误;
B、开始没有气体生成,而中间有气体生成,所以溶液的质量变化速率应该是中间那段慢,表现为图象的话就是中间那段更平缓而不是更陡;错误;
C、根据上面的化学方程式可知,等质量的盐酸反应,与氢氧化钠反应生成水比与碳酸钠反应生成的水多,所以图象曲线变的平缓,而反应完全后,没有水生成,导致水只是来自溶液本身,所以图象更加平缓;正确;
D、根据上面的化学方程式可知,等质量的盐酸反应,与氢氧化钠反应生成氯化钠和与碳酸钠反应生成的氯化钠一样多;正确。
故选:CD。

【题目】下列有关叙述、对应的化学方程式、所属基本反应类型一一对应且都正确的是( )
选项 | 叙述和化学方程式 | 基本反应类型 |
A | 拉瓦锡测得空气中氧气含量: | 分解反应 |
B | 酸雨的形成: | 化合反应 |
C | 实验室用锌和稀硫酸反应制氢气: | 置换反应 |
D | 碳与灼热的氧化铜反应: | 还原反应 |
A.AB.BC.CD.D
【题目】张玲同学为测定汉白玉中碳酸钙的质量分数,称取5.55g研碎的汉白玉粉末进行四次高温加热、冷却、称量剩余固体的重复操作。记录数据如下:
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
请计算:
(1)完全反应后产生的二氧化碳质量_____;
(2)汉白玉中碳酸钙的质量分数________。