题目内容
【题目】1869年门捷列夫发现了元素周期律,使得化学学习和研究变得有规律可循。如表列出的是1﹣18号元素的部分最高正化合价和最低负化合价。回答下列问题:
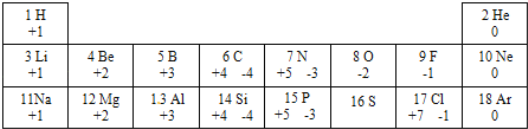
(1)金属锂、钠的化学性质有相似的原因是_____。
(2)推测16号元素最高正化合价为_____。地壳中含量最高的金属元素与非金属元素形成的化合物的化学式为_____。
(3)第三周期元素,从左到右,各原子随原子序数的增加,最外层电子数的递变规律是_____。
(4)从上表我们可以发现一些规律_____(写一条即可)。
【答案】最外层电子数相等 +6 Al2O3 由1依次递增到8 金属元素化合价都是正价,非金属元素化合价既有正价也有负价
【解析】
(1)金属锂、钠的化学性质有相似的原因是最外层电子数相等。故填:最外层电子数相等。
(2)16号元素是硫元素,硫原子最外层电子数是6,反应中最多失去6个电子,因此最高正化合价为+6;地壳中含量最高的金属元素(铝元素)与非金属元素(氧元素)形成的化合物氧化铝中,铝元素化合价是+3,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,氧化铝的化学式是。故填:+6;Al2O3。
(3)第三周期元素,从左到右,各原子随原子序数的增加,最外层电子数的递变规律是由1依次递增到8。故填:由1依次递增到8。
(4)从上表可以发现:金属元素化合价都是正价,非金属元素化合价既有正价也有负价,有些元素只有一种化合价,有些元素有多种化合价等。故填:金属元素化合价都是正价,非金属元素化合价既有正价也有负价。

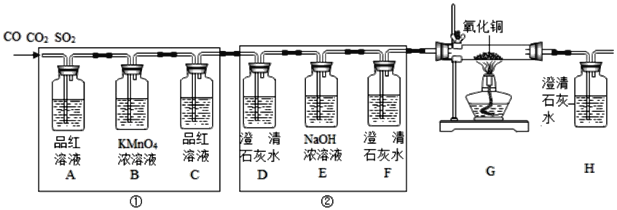
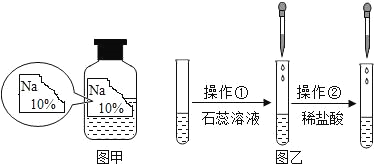
【题目】(一)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)
其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
(探究过程)
如图乙所示,在操作①后可确定溶质不是NaCl,则实验过程和实验现象应是_____;在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的_____。
(探究结论)
你认为该溶液中的溶质可能是上述假设物质中的_____,你的判断依据是_____。
(探究反思)
(1)若上述探究结论是正确的,操作②产生的气体应是_____(写化学式),实验室检验该气体的实验操作及现象是_____。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:_____。
(二)兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口_____(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有_____性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后_____(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是因_____促使盐酸形成白雾。