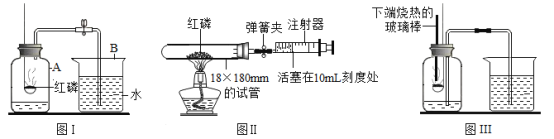
题目内容
【题目】1.6g某物质在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含C、H元素;②一定不含O元素;③可能含O元素:④一定含O元素;⑤分子中C、H原子个数比为1:2;⑥分子中C、H原子个数比为1:4,其中正确的是( )
A. ①②⑤B. ①②⑥C. ①③⑥D. ①④⑤
【答案】B
【解析】
先根据反应前后元素的种类不变,确定该物质中一定含有碳、氢两种元素,可能含有氧元素。再根据反应前后元素的质量相等,来确定氧元素是否含有。
4.4g二氧化碳中碳元素的质量=![]() =1.2g
=1.2g
3.6g水中氢元素的质量=![]() =0.4g
=0.4g
1.2g+0.4g=1.6g,与物质的质量相等,故一定不含氧元素。
C、H元素的原子个数比为:![]() ∶
∶![]() =1∶4,①②⑥正确。故选B。
=1∶4,①②⑥正确。故选B。

【题目】质量守恒定律是化学反应遵循的普遍规律。
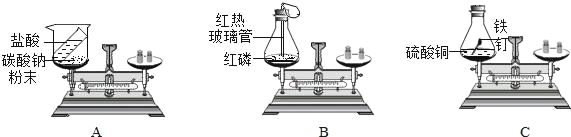
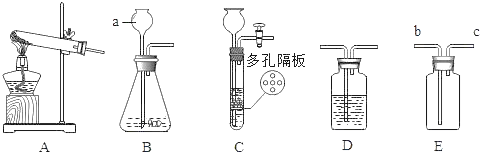
(1)上述实验方案中,不能用于验证质量守恒定律的是_____(填字母序号),其原因是_____。
(2)某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微观示意图和反应前后的质量如下表所示。
物质序号 | 甲 | 乙 | 丙 | 丁 |
|
微观 示意图 |
|
|
|
| |
反应前质量/g | 68 | 100 | 1 | 0 | |
反应后质量/g | 0 | x | y | z |
①丁的化学式为_____。
②表中的四种物质中,含氧元素的化合物是_____(填物质序号)。
③上述反应的化学方程式为_____。
④一位同学在计算x、y和z数值的过程中,列出了以下等式,其中正确的是_____(填字母序号)。
A x+y+z=169 B y+z=168
C (100﹣x):z=32:64 D (100﹣x):(y﹣1)=8:3
【题目】某厂废水中含有质量分数为4.9%的H2SO4,需中和后才能排放.某兴趣小组同学经过讨论,提出了两种中和方案,所用试剂的价格如下:
中和试剂 | 氢氧化钠 | 氢氧化钙 |
价格/(元吨﹣1) | 800 | 450 |
(1)请从经济与产物角度说明选择氢氧化钙的理由:
①_____;②_____.
(2)有同学建议用氨水进行中和,可以回收一种化肥,其化学式为_____.该废水还会引起的环境问题是_____(选填编号).
A 重金属污染 B 有毒物质污染 C 富营养化污染 D 悬浮物污染