题目内容
【题目】做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你于他们一起进行以下探究.
(提出问题)溶液中的溶质是什么物质?
(作出猜想)
(1)甲同学认为溶液中的溶质只有Na2SO4一种物质.
(2)乙同学认为溶液中的溶质有Na2SO4和_____两种物质.
(3)丙同学认为溶液中的溶质有Na2SO4和NaOH两种物质.
(查阅资料)
①Na2SO4溶液显中性.
②Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质.
(实验验证)
实验操作 | 实验现象 | 实验结论 | |
乙同学实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管内的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
丙同学实验 | 取中和反应后的溶液少许于试管中,向试管内滴加几滴无色酚酞试液 | 无色溶液变成____色 | 猜想(3)成立 |
(总结反思)戊同学根据所学化学知识和乙、丙两同学的实验现象,首先肯定猜想(1)不成立.经过进一步分析,戊同学认为猜想(2)也不成立,他的理由是____.兴趣小组的同学经过充分讨论,一致认为猜想(3)成立.
(知识拓展)
(1)生活中能否用铝制品来盛放强碱性溶液?_____(选填“能”或“不能”)
(2)乙同学的实验中铝片与____溶液发生了反应,请写出铝与该溶液发生反应的化学方程式___.
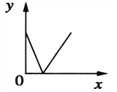
(3)镁和铝在元素周期表中处于相邻位置,向盛有100g稀硫酸的烧杯中加入一定量的Mg粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示.
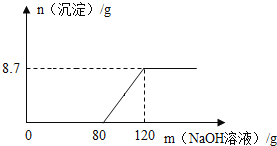
①计算该NaOH溶液溶质的质量分数____.(要求写出计算过程)
②计算该100g稀硫酸中所含溶质硫酸的质量为____g.
【答案】H2SO4 红 滴入酚酞试液后,溶液变红色,说明溶液呈碱性,溶液中不可能含有硫酸 不能 NaOH 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 30% 44.1
【解析】
作出猜想:
氢氧化钠与稀硫酸生成硫酸钠和水,恰好完全反应时,溶液中溶质是硫酸钠,氢氧化钠过量时,溶液中溶质是硫酸钠和氢氧化钠,硫酸过量时,溶液中溶质是硫酸钠和硫酸,乙同学认为溶液中的溶质有Na2SO4和H2SO4两种物质;
实验验证:
丙同学实验,取中和反应后的溶液少许于试管中,向试管内滴加几滴无色酚酞试液;无色溶液变成红色,说明溶液显碱性,猜想(3)成立;
总结反思:
经过进一步分析,戊同学认为猜想(2)也不成立,他的理由是:滴入酚酞试液后,溶液变红色,说明溶液呈碱性,溶液中不可能含有硫酸;
知识拓展:
(1)生活中不能用铝制品来盛放强碱性溶液,因为铝与氢氧化钠反应;
(2)乙同学的实验中铝片与NaOH溶液反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)①设NaOH溶液中溶质的质量分数为x,硫酸镁的质量为y。
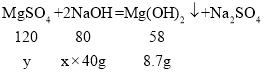
![]() ,
,![]()
解得:x=30%,y=18g;
答:该NaOH溶液溶质的质量分数为30%;
设:与氢氧化钠反应的硫酸的质量为m。
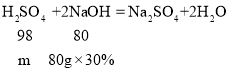
![]() m=29.4g;
m=29.4g;
设:与镁反应的硫酸的质量为n。
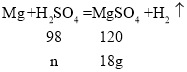
![]() n=14.7g;
n=14.7g;
100g稀硫酸中所含溶质硫酸的质量=29.4g+14.7g=44.1g;

 阅读快车系列答案
阅读快车系列答案