题目内容
10g石灰石与100g盐酸恰好完全反应,生成CO2质量为2.2g,求:(1)求石灰石中CaCO3的质量分数;
(2)反应后所得溶液中溶质质量分数是多少?
【答案】分析:(1)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量,最后根据 ×100%即可求出石灰石中碳酸钙的质量分数.
×100%即可求出石灰石中碳酸钙的质量分数.
(2)根据反应后反应后所得溶液为氯化钙溶液以及溶液中溶质质量分数=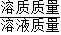 ×100%进行解答.
×100%进行解答.
解答:解:(1)设碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 2.2g

x=5.0g
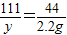
y=5.55g
石灰石中CaCO3的质量分数= =50%.
=50%.
(2)反应后所得溶液中溶质质量分数=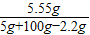 ×100%=5.4%
×100%=5.4%
答:(1)石灰石中CaCO3的质量分数50%;(2)反应后所得溶液中溶质质量分数是5.4%.
点评:有关反应前后减少的质量的计算是初中化学计算的一个重点内容,反应前后总装置减少的质量一般为生成气体的质量,反应前后固体物质减少的质量一般为参加反应的固体的质量(也有例外).
 ×100%即可求出石灰石中碳酸钙的质量分数.
×100%即可求出石灰石中碳酸钙的质量分数.(2)根据反应后反应后所得溶液为氯化钙溶液以及溶液中溶质质量分数=
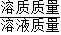 ×100%进行解答.
×100%进行解答.解答:解:(1)设碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 2.2g

x=5.0g
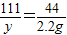
y=5.55g
石灰石中CaCO3的质量分数=
 =50%.
=50%.(2)反应后所得溶液中溶质质量分数=
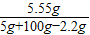 ×100%=5.4%
×100%=5.4%答:(1)石灰石中CaCO3的质量分数50%;(2)反应后所得溶液中溶质质量分数是5.4%.
点评:有关反应前后减少的质量的计算是初中化学计算的一个重点内容,反应前后总装置减少的质量一般为生成气体的质量,反应前后固体物质减少的质量一般为参加反应的固体的质量(也有例外).

练习册系列答案
相关题目
a、常熟白雪冰箱厂新购进了一批黄铜(铜锌合金).为了测定这批黄铜中铜的质量分数,化验人员将取来的样品先加工成粉未,然后利用该粉末与稀硫酸在烧杯内发生反应.在所进行的三次实验中,只有一次所取用的稀硫酸与黄铜样品是恰好完全反应的.有关实验数据记录如下:
请分析实验数据,完成下列问题:
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为 ,该黄铜样品中铜的质量分数为 .
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答 小题(请在横线上填写题号“a”或“b”,以确认你的选择).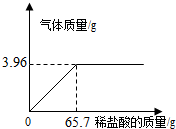
| 实验次数 | 1 | 2 | 3 |
| 所取黄铜样品的质量/g | 10.0 | 10.0 | 20.0 |
| 加入稀硫酸的质量/g | 100.0 | 80.0 | 80.0 |
| 反应后烧杯内剩余物质的质量/g | 109.8 | 89.8 | 99.8 |
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答

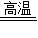 CaO+CO2↑,这一化学反应要______(填“产生”或“吸收”)热量.
CaO+CO2↑,这一化学反应要______(填“产生”或“吸收”)热量.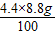
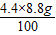 8.8g
8.8g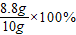 =88%
=88%