题目内容
【题目】研究和控制化学反应条件有重要意义。
①同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以制取氧气,同学们可以选择下列 (11) (选填编号)装置(气密性良好)进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是 (12) ,因此加热不适合用于双氧水制取氧气。
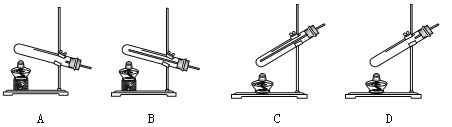
②同学们还想探究双氧水的溶质质量分数对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | 67 |
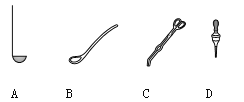
I.取用二氧化锰的仪器是 (13) (选填编号)。
II.写出上述反应的化学反应方程式 (14) 。
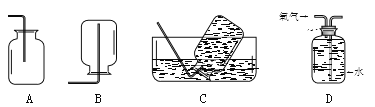
III.本实验中收集氧气选用的装置有 (15) (选填编号)。
IV.实验2中双氧水溶质质量分数为 (16) 。
V.实验3中,加入的二氧化锰质量为 (17) g。
VI.相同条件下,实验3产生氧气的速率最快,说明 (18) 。
【答案】(11)D;(12)氧气中含有较多的水蒸气;(13)B;(14)![]() ;(15)C和D;(16)12%;(17)5;(18)相同条件下,双氧水的溶质质量分数越大,反应速率越快;
;(15)C和D;(16)12%;(17)5;(18)相同条件下,双氧水的溶质质量分数越大,反应速率越快;
【解析】
试题分析:(11)考虑是固液加热及便于气体排出,选D;(12)加热水也会加快蒸发,增大水蒸气含量,阻止木炭复燃;(13)二氧化锰是固体粉末;(14)过氧化氢在二氧化锰的催化下分解成氧气和水;(15)氧气不溶于水可选用C、D,密度比空气大可选用向上排空气法,但A中导管没有伸到底部,错误;(16)溶质质量=20g×30%=6g,溶液质量=20g+30g=50g,那么双氧水溶质质量分数=6g/50g×100%=12%;(17)控制变量,实验变量是双氧水的溶质质量分数,因此其它量都得一致;(18)实验三的溶质质量分数是最大的,那么相同条件下,双氧水的溶质质量分数越大,反应速率越快;