题目内容
【题目】为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143. 5gAgCl固体;
②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为____________。
(2)第___________组实验恰好完全反应。
(3)原混合溶液中FeCl2的质量分数为_________? (计算结果精确到 0.1%)
【答案】12.8 四 15.9%
【解析】
(1)(2)根据给出的数据可以看出,每加入3g的铁粉,对应的铜的质量为3.2g,所以第三组时m=3.2g×4=12.8g,而第四次加入15g铁粉,铜生成16g后不再增加,说明此时恰好完全反应;
(3)设原混合溶液中CuCl2的质量为x,
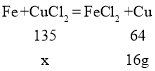
![]()
x=33.75g
设氯化铜对应的氯化银的质量为y,
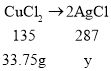
![]()
y=71.75g
则氯化亚铁对应的氯化银的质量为143.5g-71.75g=71.75g,
设原混合溶液中FeCl2的质量分数为a,
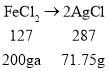
![]()
a≈15.9%
答:原混合溶液中FeCl2的质量分数为15.9%。

练习册系列答案
相关题目