题目内容
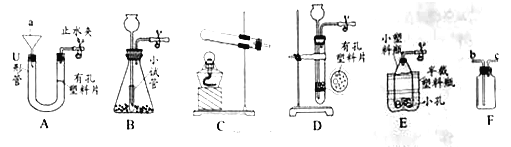
【题目】实验室部分装置如A-E图所示。
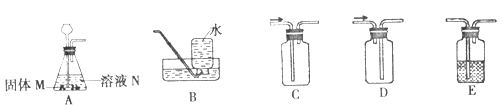
请回答下列问题:
(1)用所给装置制取并收集不同气体,填写下表空白。
固体M | 溶液N | 制取的气体 | 收集装置 |
大理石 | _____① _______ | CO2 | _____② ______ |
____③ ______ | 过氧化氢溶液 | O2 | ____④ ____或C |
锌粒 | 稀硫酸 | ____⑤ ____ | B或____⑥ ____ |
(2)收集干燥的CO2还需要用装置E,E中盛装的试剂为_______⑦ ______。
(3)用上图装置A制取O2时发生反应的化学方程式为________⑧ ________。
【答案】①稀盐酸 ②C ③二氧化锰 ④B ⑤H2 ⑥D ⑦浓硫酸 ⑧2H2O2 MnO2 2H2O+O2↑
【解析】(1)大理石与稀盐酸反应生成二氧化碳,二氧化碳密度比空气大,故用万能瓶收集时,应从长管通入,故填:①稀盐酸 ②C;过氧化氢溶液在加入二氧化锰的条件下,分解生成水和氧气。由于氧气密度比空气大且不易溶于水,故可采用排水法和向上排空气法(用万能瓶收集时,应从长管通入)收集。故填:③二氧化锰 ④B;锌粒与稀硫酸反应生成氢气,氢气密度比空气小,用万能瓶收集时,应从短管通入。氢气难溶于水,可以用排水法收集。故填:⑤H2 ⑥D;
(2)浓硫酸有吸水性,故收集干燥的CO2还需要用装置E,E中盛装的试剂为浓硫酸;
(3)装置A是固液混合常温型发生装置,故用装置A制取O2时发生反应的化学方程式为:2H2O2 MnO2 2H2O+O2↑。

【题目】某密闭容器中有X、氧气、二氧化碳三种物质,在一定条件下充分反应,反应前后各物质质量的数据记录如下:
物质 | X | O2 | CO2 | H2O |
反应前的质量/g | 46 | 128 | 1 | 0 |
反应后的质量/g | 0 | 待测 | 89 | 54 |
在下列判断中,正确的是( )
A. 物质X由碳、氢元素组成 B. 物质X由碳、氢、氧元素组成
C. 充分反应后剩余氧气质量为16克 D. 生成CO2与H2O的质量比是89:54