题目内容
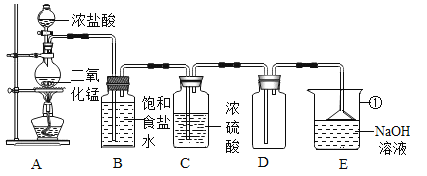
【题目】某兴趣小组同学在帮助老师整理实验室药品时,发现一瓶未塞瓶塞的氢氧化钠溶液,他们怀疑氢氧化钠已经变质,于是对该溶液中溶质的成分展开探究,请你帮助他们一起完成。
(提出问题)该瓶溶液溶质的成分是什么?
(作出猜想)猜想一:氢氧化钠 猜想二:碳酸钠和氢氧化钠 猜想三:碳酸钠
同学们猜想溶液中含有碳酸钠的原因是_____(用方程式表示)。
(实验验证)同学们设计并进行如下实验:
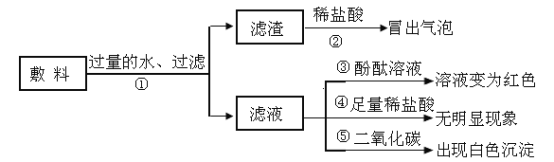
步骤一:取少量该溶液,滴入适量的_____溶液,产生白色沉淀,猜想_____不成立。
步骤二:取步骤一后所得上层清液,滴入氯化铁溶液,出现_____现象,猜想二成立。
(反思评价)步骤二中的氯化铁溶液,可用下列物质中_____(填序号)代替,也能达到同样的实验目的。
A 二氧化碳 B 酚酞溶液 C 氢氧化铜 D 氯化铵溶液
(拓展迁移)废液处理:兴趣小组同学欲将这瓶变质的氢氧化钠溶液变为氯化钠回收利用,他们向此溶液中加入一定量的稀盐酸,检验所加稀盐酸是否过量可选用下列物质中的_____(填序号)。
A pH试纸 B 氧化铜 C 硝酸银溶液 D 氢氧化铁
【答案】![]() CaCl2或BaCl2 一 红褐色沉淀 BD ABD
CaCl2或BaCl2 一 红褐色沉淀 BD ABD
【解析】
[作出猜想]溶液中含有碳酸钠是因为氢氧化钠溶液未塞瓶塞,溶液中的氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式是![]() ;
;
故填:![]() 。
。
[实验验证]步骤一:取少量该溶液,滴入适量的氯化钙溶液或氯化钡溶液,产生白色沉淀,说明溶液中一定含有碳酸钠,猜想一不成立;
故填:CaCl2或BaCl2 一。
步骤二:取步骤一后所得上层清液,滴入氯化铁溶液,清液中的氢氧化钠与氯化铁反应生成红褐色沉淀,证明猜想二成立;
故填:红褐色沉淀。
[反思评价]步骤二中的氯化铁溶液是检验溶液中是否含有氢氧化钠,下列物质中:
A、二氧化碳与氢氧化钠反应无明显现象,不可以代替;
B、酚酞溶液加入氢氧化钠溶液中,溶液变红,可以代替;
C、氢氧化铜不会与氢氧化钠反应,不可以代替;
D、氯化铵溶液与氢氧化钠反应生成氯化钠、氨气和水,有刺激性气味的气体产生,可以代替;
故选:BD。
[拓展迁移]检验所加稀盐酸是否过量,也就是检验反应后的溶液中是否含有稀盐酸;
A、pH试纸,氢氧化钠与稀盐酸恰好完全反应生成氯化钠,溶液的pH=7,用pH试纸测量溶液的pH,若溶液的pH<7,说明溶液中含有稀盐酸;
B、氧化铜,氧化铜能与稀盐酸反应,加入氧化铜粉末,若粉末减少,溶液由无色变为蓝色,说明溶液中有稀盐酸;
C、硝酸银溶液,硝酸银与氯化钠也会反应生成白色沉淀,故不能检验溶液中是否含有稀盐酸;
D、氢氧化铁固体能与稀盐酸反应,加入氢氧化铁固体,若固体减少,溶液由无色变为黄色,说明溶液中有稀盐酸;
故选:ABD。

【题目】某兴趣小组对石灰石样品进行如下实验取 12g 样品放入烧杯中,将 100g 稀盐酸分 4 次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:第 4 次加入稀盐酸后所得溶液中 CaCl2的质量分数。(写出计算过程,最终结果保留 0.1%)。
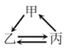
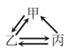
【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是
选项 | A | B | C | D | |
转化关系 |
|
|
|
| |
物质 | 甲 | H2O2 | C | CaCO3 | FeCl2 |
乙 | O2 | CO | CO2 | Fe | |
丙 | H2O | CO2 | Na2CO3 | Fe2O3 | |