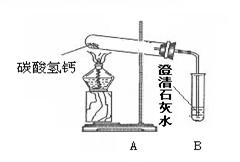
��Ŀ����
Ϊ��̽��������Һ����һ�����ӣ�H2O��H+��SO42-����ʹָʾ����ɫ����Ƶ�ʵ�鲽�����£�
���ڵ�һ֧�Թ��м���Լ2mL����ˮ�����뼸����ɫʯ����Һ���۲�����
���ڵڶ�֧�Թ��м���Լ2mLNa2SO4��PH=7����Һ�����뼸����ɫʯ����Һ���۲�����
���ڵ���֧�Թ��м���Լ2mLHCl��Һ�����뼸����ɫʯ����Һ���۲�����
ͨ������ʵ��̽��������ش��������⣺
��1����ļ�����
��2��ʵ��ٺ�ʵ���˵��
��3��ʵ��ۿ����������� ����ó��Ľ�����
���ڵ�һ֧�Թ��м���Լ2mL����ˮ�����뼸����ɫʯ����Һ���۲�����
���ڵڶ�֧�Թ��м���Լ2mLNa2SO4��PH=7����Һ�����뼸����ɫʯ����Һ���۲�����
���ڵ���֧�Թ��м���Լ2mLHCl��Һ�����뼸����ɫʯ����Һ���۲�����
ͨ������ʵ��̽��������ش��������⣺
��1����ļ�����
��2��ʵ��ٺ�ʵ���˵��
��3��ʵ��ۿ����������� ����ó��Ľ�����
��1��SO42-��ʹָʾ����ɫ��2��H2O��SO42-������ʹ��ɫʯ����Һ��죨3����ɫʯ���죻H+��ʹָʾ����ɫ������Ҫ�����һ�£�
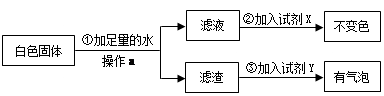
������룺���������д��ڵ����������м��裻
���ʵ�飺���ݼ���ֱ���֤�к���ˮ���ӡ�����������Լ������ӵ���Һ�ֱ����ʵ����н��
��˼�����ۣ������������������Ӧ������������ˮ�Լ���������Һ�к���ˮ���ӽ��н��
��1���������д���ˮ���ӡ�����������Լ������ӽ��в��룮����1�ܳ�ȥ�����������H2O������2�ܳ�ȥ�����������H+������3�ܳ�ȥ�����������SO42�����ʴ�Ϊ��SO42-��ʹָʾ����ɫ��
��2��H2O��SO42-������ʹ��ɫʯ����Һ��졣
��3����ɫʯ����Һ��죬H+��ʹָʾ����ɫ��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ