题目内容
【题目】某次实验结束时,将含有CuSO4、ZnSO4、 FeSO4 的废液倒在废液缸里,考虑到废液直接排放会造成水污染,某化学活动小组利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属。实验流程如下:

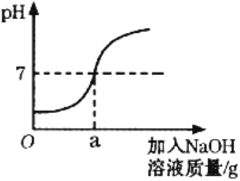
(1)步骤①中锌粉必须过量的目的是让废液中的______________完全反应。该流程中发生的置换反应共有_________个。 写出步骤③反生的反应的化学方程式______________。
(2)若实验过程中的物质损失可以忽略,要测定废液中的硫酸锌的质量分数,除了需要测定废液的质量、多步处理所得到的固体ZnSO4的质量,还需要测量______________这一种物质的质量。
(3)若在上述实验流程的基础上,只需要补充一个实验方案, 即可得出金属活动性Cu<H<Fe<Zn,写出实验操作及现象。________
【答案】硫酸铜、硫酸亚铁 3 ![]() 过量锌粉 将打磨过的铁片放入少量稀硫酸中,发现有气泡生成
过量锌粉 将打磨过的铁片放入少量稀硫酸中,发现有气泡生成
【解析】
(1)步骤①中锌粉必须过量的目的是让废液中的硫酸铜、硫酸亚铁完全反应;
在废液中加入过量锌粉,锌和硫酸铜反应生成硫酸锌和铜,该反应的化学方程式为:![]() ,锌和硫酸亚铁反应生成硫酸锌和铁,该反应的化学方程式为:
,锌和硫酸亚铁反应生成硫酸锌和铁,该反应的化学方程式为:![]() ,过滤,固体A中为铜、铁和过量的锌粉,用磁铁使铁和铜、锌分离,固体C为铜和锌,加入适量稀硫酸,铜不与稀硫酸反应,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:
,过滤,固体A中为铜、铁和过量的锌粉,用磁铁使铁和铜、锌分离,固体C为铜和锌,加入适量稀硫酸,铜不与稀硫酸反应,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:![]() ;
;![]() ,
,![]() ,
,![]() 都符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,故置换反应有3个;
都符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,故置换反应有3个;
步骤③反生的反应的化学方程式为:![]() ;
;
(2)要测定废液中的硫酸锌的质量分数,除了需要测定废液的质量、多步处理所得到的固体ZnSO4的质量,还需要测量过量锌粉这一种物质的质量,由![]() ,
,![]() ,
,![]() 可知,过量锌粉全部转化为了硫酸锌,可通过锌粉的质量推算出反应生成的硫酸锌的质量,通过多步处理所得到的固体ZnSO4的质量减去反应生成的硫酸锌的质量,即可得出废液中硫酸锌的质量,继而计算出废液中硫酸锌的质量分数;
可知,过量锌粉全部转化为了硫酸锌,可通过锌粉的质量推算出反应生成的硫酸锌的质量,通过多步处理所得到的固体ZnSO4的质量减去反应生成的硫酸锌的质量,即可得出废液中硫酸锌的质量,继而计算出废液中硫酸锌的质量分数;
(3)通过上述实验流程可知,锌能与硫酸铜、硫酸亚铁反应,说明在金属活动性顺序里,锌位于铁、铜之前,铜不与稀硫酸反应,说明在金属活动性顺序里,铜位于氢之后,现在只需证明在金属活动性顺序里,铁位于氢之前即可,故实验方案为:将打磨过的铁片放入少量稀硫酸中,发现有气泡生成,说明在金属活动性顺序里,铁位于氢之前。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案