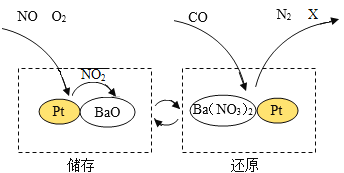
��Ŀ����
����Ŀ���ᡢ����������������о��й㷺����;����ҵ�ϳ��õ�ⱥ��ʳ��ˮ�ķ�����ȡ�ռij��ѧ��ȤС��Ϊ��̽�����õĹ�ҵ�ռ�ijɷ֣�����������ʵ�飺
(1)ȡ������Ʒ���ձ��У������м������ϡ���ᣬ�۲쵽�����ݲ�����˵����Ʒ�к���____________________(�ѧʽ) �����������ձ��м���������������Һ�������˰�ɫ����������ͬѧ�ǵó����ۣ���Ʒ��____________________(�һ��"��һ���� )�����Ȼ��ơ�
(2)������Ҫȷ���Ƿ����Ȼ����⣬����Ҫȷ����Ʒ���Ƿ����������ơ����ǣ�����ֽ���������ʵ�飺
����ȡ������Ʒ�ܽ���ˮ�������м�������������Һ��������ɫ������Ȼ����ˡ�ϴ�ӣ�
��ȡ������Һ�����̪��Һ����Һ��죻
������Һ�м�������ϡ���ᣬ�ٵ�����������Һ�������ɫ������
�ɴ��жϣ�ʵ����������ijɷ���____________________(�ѧʽ)��
(3)��������ʵ�飬�ó��Ľ�����ȷ����___________________(����ĸ)��
A.��Ʒ����NaCl
B.��Ʒ��ֻ��NaOH��Na2CO3
C.��Ʒ����NaOH
D.��Ʒ����Na2CO3��NaOH��NaCl
(4)����ȤС���ͬѧͨ���������ϵ�֪����ⱥ��ʳ��ˮ�����������ռ����⣬����������������������д���÷�Ӧ�Ļ�ѧ����ʽ____________________��
���𰸡�Na2CO3 ��һ�� CaCO3 D 
��������
(1)�������ƾ��û�������еĶ�����̼��Ӧ����̼���ƣ���Ʒ�м���ϡ���������ݲ�����˵������̼���ƣ��ڼ���̼����ʱ������Լ���ϡ������������Ϊ����Һ�������������ӣ��������������а�ɫ����������Ҳ����˵��ԭ��Һ�к����Ȼ�����ϡ������̼���Ʒ�ӦҲ�������Ȼ��ƣ����Բ���ȷ����Ʒ���Ƿ����Ȼ��ƣ����Na2CO3 ��һ����
(2)��Ʒ�м���������������Һ��̼������ȫ��Ӧ����ʱ�����İ�ɫ����Ϊ̼��ƣ����CaCO3��
(3) ��Ϊ̼�����ѱ��������ȫ��Ӧ����������Һ�μӷ�̪��Һ�����˵����Ʒ�к����������ơ���Һ�м���ϡ�����ܽ�����������ȫ��Ӧ�����ټ����������а�ɫ����������˵�������˲�����ϡ����İ�ɫ������ԭ��Ʒ��һ�������Ȼ��ơ�������������Ʒ�к��е�������Na2CO3��NaOH��NaCl����ѡD��
(4) ��ⱥ��ʳ��ˮ���ɵ��������ռ������������������Ԫ�ص�������Na��O��H��Cl�����������غ㶨������֪��Ӧ���е�Ԫ��Ҳ��������Ԫ�ء����ɴ˿��ƶϣ�ʳ��ˮ�е�ˮҲ�����˻�ѧ��Ӧ���˷�Ӧ�Ļ�ѧ����ʽΪ��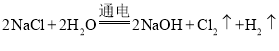 �����
����� ��
��

����Ŀ��ʯ��ʯ����Ҫ�Ŀ�ʯ֮һ��ѧУ�о���ѧϰС��Ϊ�˲ⶨ���ؿ�ɽʯ��ʯ��̼��Ƶ�����������ȡ����һЩ��ʯ��Ʒ����ȡϡ����200g,ƽ���ֳ�4�ݣ�����ʵ�飬������£�
ʵ�� | 1 | 2 | 3 | 4 |
������Ʒ������/g | 5 | 10 | 15 | 20 |
����CO2������/g | 1.76 | 3.52 | 4.4 | m |
��1���ļ��η�Ӧ�п�ʯ��̼�����ʣ�ࣺ________
��2���ϱ���m����ֵ��________
��3���Լ��������ʯ��ʯ����̼��Ƶ���������________